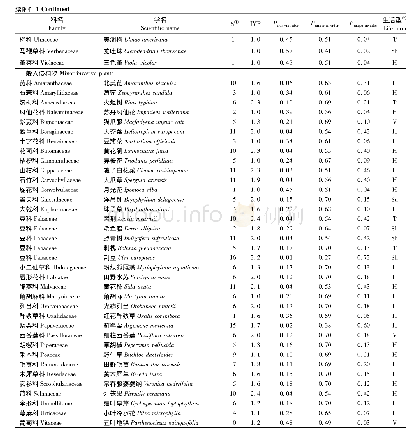
《表1 美国高风险产品回顾性评估情况统计表》
美国对药品、医疗器械监管较为严格,注册程序复杂,审批流程过长,进入时间慢,导致成本增加,从而引起了业界和公众的不满[6]。为解决此类问题,在2014年-2015年期间,FDA利用重新分类程序开展了对已上市高风险医疗器械产品安全性和有效性的全面评估工作。FDA综合医疗器械产品的临床研究数据和临床使用的实际情况,对高风险产品进行了上市前和上市后数据要求的必要性评估,依据评估结果对相应产品的管理类别进行调整,通过此次评估,建议降类的有32项,约占15%;175项仍保持现管理类别,其中27项虽然未降低管理类别,但是调整了部分上市前的数据要求,加强了上市后的要求。具体评估结果见表1。此阶段评估虽然对近60项产品给出了降类或者减少上市前数据要求的建议,实际在2014年-2015年仅完成8项调整,由此可见,调整上市后产品的管理类别和监管强度,确实是一项挑战性非常强的工作。
| 图表编号 | XD0087850200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.03.30 |
| 作者 | 王越、张春青、郑佳、郭世富、母瑞红、余新华 |
| 绘制单位 | 中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院、中国食品药品检定研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

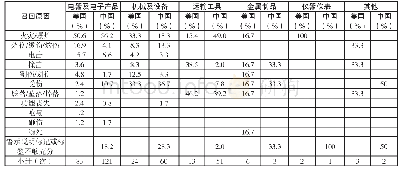

![表2 美国杂志《建设回顾》统计[22]](http://bookimg.mtoou.info/tubiao/gif/SLKJ202007042_01900.gif)