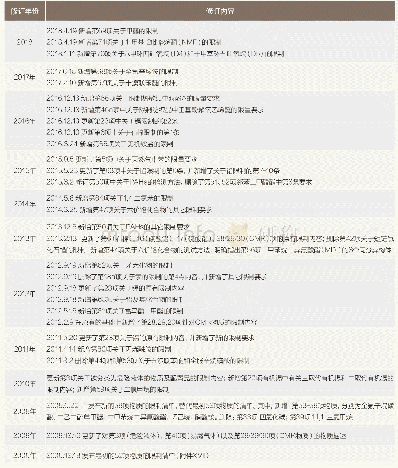
《表2 USP元素杂质相关控制要求的增修订历程》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《欧美药典及ICH元素杂质指导原则增修订历程及对中国药典的启示》
在USP 35第二增补版中提及的15种元素杂质是以ICH Q3D元素杂质指导原则第二阶段草案为依据的[14]。由于USP和ICH的工作进程不同,两者在不同时期内容不尽一致,相关规定有所差异。与USP 35第二增补版相比,ICH Q3D涉及的元素杂质种类更多,有9种元素(钴、铊、金、硒、银、锂、锑、钡、锡)在USP中没有规定限度。因此,在2017年12月后,USP修订了通则<232>中的元素杂质种类和限度,与ICH规定保持一致,并规定在2018年1月1日之后,针对USP品种,提交改良型新药申请(NDA)、仿制药的申请(ANDA)应符合USP通则<232>、<233>。针对非USP品种,申请人提交新的NDA、ANDA时,应该遵循ICH Q3D。USP对元素杂质控制的增修订历程见表2[16]。
| 图表编号 | XD0083306900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.20 |
| 作者 | 徐昕怡、刘贞 |
| 绘制单位 | 国家药典委员会、江西省药品检验检测研究院 |
| 更多格式 | 高清、无水印(增值服务) |