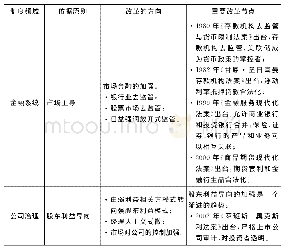
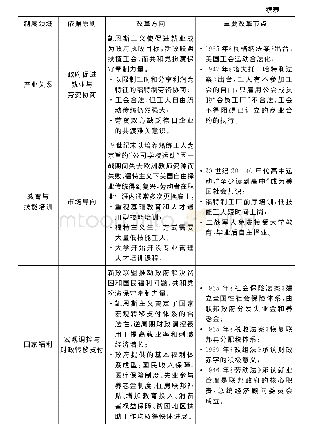
《表1 ICH Q3D历史进程的主要节点[4]》
![《表1 ICH Q3D历史进程的主要节点[4]》](http://bookimg.mtoou.info/tubiao/gif/ZGYS201906004_00700.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《欧美药典及ICH元素杂质指导原则增修订历程及对中国药典的启示》
2009年10月,ICH批准制定Q3D金属杂质指导原则[4],旨为药品中的金属杂质定性和定量控制提供全球性政策。ICH指导原则须经过四个阶段方可公布,在最后第五阶段被ICH区域内的各国药品监管部门采纳。2013年7月,ICH将Q3D指导原则的题目由“金属杂质指导原则”修改为“元素杂质指导原则”。2014年12月,ICH发布了Q3D第四阶段正式文件,其历史进程中的主要节点见表1[4]。Q3D指导原则分为三个部分:评估潜在元素杂质的毒性数据,确定每一种有毒元素的每日允许暴露量(PDE),以及运用ICH Q9[5]质量风险管理指导原则来评估和控制药品中的元素杂质[3,6]。Q3D的出台,有利于帮助企业通过风险评估来判断对哪些元素进行额外控制,为药品制订合理的元素限度[6]。Q3D中未规定元素杂质的检测方法,药品注册申请人可参考ICH Q2分析方法验证指导原则采用任何经验证的检测方法[7-11]。
| 图表编号 | XD0083306800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.20 |
| 作者 | 徐昕怡、刘贞 |
| 绘制单位 | 国家药典委员会、江西省药品检验检测研究院 |
| 更多格式 | 高清、无水印(增值服务) |