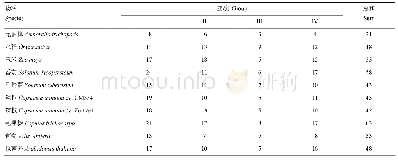
《表2 不同物种ADSCs流式染色情况》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《小鼠、大鼠、食蟹猴与人的脂肪干细胞分离培养方法和生物学特性的比较分析》
分别取hADSCs、m ADSCs、r ADSCs、cADSCs第3代的细胞,PBS洗2次后培养瓶中加入0.25%Trpsin-0.04%EDTA,37℃下反应5 min,吸管反复吹打,镜下确认细胞完全漂浮和分离,加入等量的细胞培养液中和胰蛋白酶,进行计数,将1×106的细胞分装于1.5 m L离心管,离心后弃上清。各物种染色情况如表2:hADSCs和cADSCs分别每管加入40μL PBS+5μL CD90(FITC)、5μL CD29(PerCP-Cy5)、5μL CD34(APC-Cy7)、5μL CD31(PE-Cy7)人单克隆抗体,m ADSCs每管加入40μL PBS+5μL CD90(FITC)、5μL CD29(PE)、5μL CD45(PerCP-Cy5)、5μL CD31(APC-Cy7)小鼠单克隆抗体,r ADSCs每管加入40μL PBS+5μL CD90(PE)、CD29(PE-Cy7)、CD34(APC)、CD31(BV421)大鼠单克隆抗体,4℃避光孵育30 min,PBS洗3次,1500 r/min离心5 min,20μL PBS重悬,并用同型对照单克隆抗体确定背景标记后,流式细胞仪分析染色细胞,FlowJo软件计算细胞表面抗原阳性表达率(单位用百分比表示)。
| 图表编号 | XD0082385700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.30 |
| 作者 | 李珂雅、石桂英、高舒平、白琳、秦川 |
| 绘制单位 | 中国医学科学院医学实验动物研究所北京协和医学院比较医学中心国家卫生健康委员会人类疾病比较医学重点实验室国家中医药管理局人类疾病动物模型三级实验室、中国医学科学院医学实验动物研究所北京协和医学院比较医学中心国家卫生健康委员会人类疾病比较医学重点实验室国家中医药管理局人类疾病动物模型三级实验室、中国医学科学院医学实验动物研究所北京协和医学院比较医学中心国家卫生健康委员会人类疾病比较医学重点实验室国家中医药管理局人类疾病动物模型三级实验室、中国医学科学院医学实验动物研究所北京协和医学院比较医学中心国家卫生健康委 |
| 更多格式 | 高清、无水印(增值服务) |
![表1 部分锥猎蝽亚科物种的染色中心组成[10-11,27-29]](http://bookimg.mtoou.info/tubiao/gif/ZMSK202101028_01700.gif)