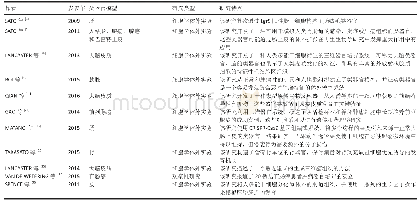
《表1 肿瘤类器官研究现状》
DBZ:notch抑制剂;A83-01:肿瘤生长因子βⅠ抑制剂;BME:基底膜提取物;Y-27632:rho相关卷曲螺旋形成蛋白激酶(ROCK)抑制剂;B27:一种细胞培养添加剂;SB202190:p38 MAPK抑制剂;SPOP:斑点状痘病毒和锌指结构域蛋白;TMPRSS2:跨膜丝氨酸蛋白酶;ERG:ETS(E-twenty six)相关基因;SPINK
肿瘤组织类器官是利用肿瘤原发灶或转移灶培养而来的体外模型[36-37]。目前,学者们已成功培养出了多种肿瘤组织类器官,包括来源于食管[38]、胃[39]、肝[40]、胰[44]、结肠[37]、乳腺[42]和子宫内膜[43]的原发肿瘤及结肠[37]、前列腺[36]和乳腺[42]恶性肿瘤的转移病灶。肿瘤类器官,是在三维培养条件下,利用含有特殊细胞因子的培养基,将分离后的肿瘤细胞培育成类球体集落,该培养产物可长期培养、传代,表现出具有与其来源肿瘤相同的基因表达谱、突变位点、肿瘤标志物、组织形态学和临床病理类型,在裸鼠移植后可成瘤,有侵袭、转移等与原肿瘤相似的临床特性。以Li等[38]建立的食道腺癌类器官为例,细胞来源于食道腺癌患者的手术切除标本。采用三维培养系统,以基底膜提取物(basement membrane extract,BME)作为细胞外基质,加入Wnt3a、R-spondin-1、Noggin、EGF、FGF10、SB202190、A83-01、B27和烟酰胺等因子进行培养。31例尝试建模样品中有10例成功,其中9例可传代>6个月,传代过程中没有遗传物质的改变。研究者总结建模成功率低的可能原因包括初始肿瘤细胞量少、微生物污染、成纤维细胞快速生长和生长停滞。组织学方面,该研究对类器官进行了免疫组化染色,评估了上皮特异性标记物的表达,发现泛细胞角蛋白(pan-cytokeratin)表达,无波形蛋白(vimentin)表达,表明类器官来源于上皮细胞。另外,10例类器官中有8例发现p53基因的突变,还发现了PIK3CA,CDKN2A和KCNQ3等食管腺癌特异的突变位点,其缺失、过表达或野生型的状态均与原肿瘤一致。基因组学方面,该研究对食管腺癌类器官进行了全基因组测序,发现类器官与原始肿瘤一样为“多克隆”。各类器官之间存在基因异质性,包括不同的单核苷酸位点变异、基因插入与缺失和染色体结构变异。经检验,其基因突变与原肿瘤基本一致,证实了此类器官模型对原肿瘤基因组的稳定继承。mRNA测序也表明食管腺癌类器官与原肿瘤有一致的基因表达谱。不过该研究未进行体内培养,如肿瘤类器官的裸鼠移植试验,未证实其体内成瘤、侵袭和转移等特性。即使如此,该研究仍具有巨大的研究意义,在肿瘤的发生发展、药物筛选及个体化治疗等方面具有广阔的研究前景。有关其他类型肿瘤类器官的特点归纳见(表1)。
| 图表编号 | XD0080604700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.01 |
| 作者 | 董研博、王健、郑梦竹、刘良发、李山虎 |
| 绘制单位 | 首都医科大学附属北京友谊医院耳鼻咽喉头颈外科、军事科学院军事医学研究院生物工程研究所细胞工程实验室、军事科学院军事医学研究院生物工程研究所细胞工程实验室、首都医科大学附属北京友谊医院耳鼻咽喉头颈外科、军事科学院军事医学研究院生物工程研究所细胞工程实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式