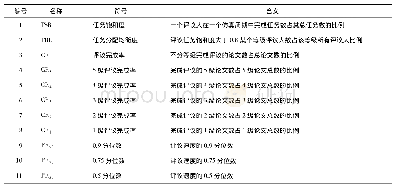
《表1 符合GLP流程及条件的组织病理学同行评议的关键要求和责任要点》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《非临床毒理学试验中组织病理学同行评议的GLP流程及关键点探讨》
为了有效地采用OECD、FDA和原CFDA对于组织病理学同行评议过程的GLP质量体系要求,从试验计划到报告应采用5个W和1个H的形式(5W1H),即Why(为什么)、What(何事)、Who(何人)、Where(何地)、When(何时)以及How(如何)。根据OECD、FDA和原CFDA[2,10,12]对符合GLP标准的试验或试验阶段进行的任何活动的规定,“Why”部分是GLP质量体系的基本要求。其余部分(4W1H)为理解同行评议的条件和达到合规要求提供了方法和手段。表1详细说明了4W1H在主要GLP流程中的应用,并介绍了组织病理学同行评议的适用条件。这些信息可以根据试验方案或试验方案变更内容的规定直接应用。如果病理学工作组对同行评议有任何监管方面的要求,那么可以按照监管机构的指示来使用这些信息。组织病理学同行评议流程和条件的关键要求和责任要点见表1。
| 图表编号 | XD0046015600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.08 |
| 作者 | 霍桂桃、杨艳伟、林志、张頔、耿兴超、霍艳、王雪、屈哲、吕建军 |
| 绘制单位 | 中国食品药品检定研究院国家药物安全评价监测中心药物非临床安全评价研究北京市重点实验室、中国食品药品检定研究院国家药物安全评价监测中心药物非临床安全评价研究北京市重点实验室、中国食品药品检定研究院国家药物安全评价监测中心药物非临床安全评价研究北京市重点实验室、中国食品药品检定研究院国家药物安全评价监测中心药物非临床安全评价研究北京市重点实验室、中国食品药品检定研究院国家药物安全评价监测中心药物非临床安全评价研究北京市重点实验室、中国食品药品检定研究院国家药物安全评价监测中心药物非临床安全评价研究北京市重点实 |
| 更多格式 | 高清、无水印(增值服务) |