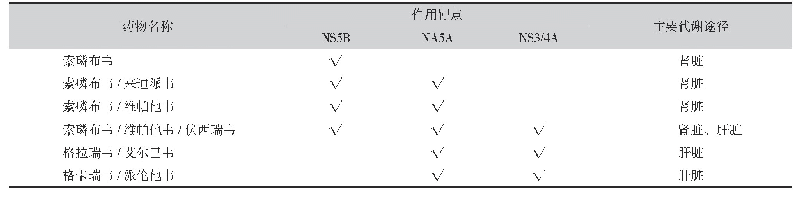
《表1 CFDA批准的DAAs及简要介绍1)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《直接抗病毒药物治疗HCV相关肝硬化的效果及安全性》
注:GT,基因型;1) 药物适应证及禁忌证可能仍处于不断更新中;2) DCV同时被批准与SOF联合用于GT 1~6型HCV感染;3) Ritonavir是肝脏药物代谢酶抑制剂,无抗HCV效果
目前应用于临床的DAAs主要分为以下3类:(1)NS5B聚合酶抑制剂,包括Sofosbuvir(SOF)、Dasabuvir(DAS);(2)NS3/4A丝氨酸蛋白酶抑制剂,包括Asunaprevir(ASV)、Grzoprevir(GZR)、Paritaprevir(PTV)、Simeprevir(SIM)、Telaprevir(TVR)、Boceprevir(BOC)、Danoprevir(DNVr);(3)NS5A复制复合物蛋白抑制剂,包括Daclatasvir(DCV)、Elbasvir(EBR)、Ledipasvir(LDV)、Ombitasvir(OBT)、Velpatasvir(VEL)[6](为便于描述且与相关文献资料保持一致,后文涉及上述药物名称均使用药物通用名的缩写形式表述)。随着国际中心研究的开展及基于中国患者的大规模临床试验数据支持,中国食品药品监督管理局(CFDA)也逐步批准了部分DAAs在国内上市[7]。到目前为止CFDA批准的DAAs包括:盐酸达拉他韦片(百立泽)、阿舒瑞韦胶囊(速维普)、艾尔巴韦格拉瑞韦片(择必达)、索磷布韦片(索华迪)、奥比帕利片(维建乐)、达赛布韦片(易奇瑞)、丹诺瑞韦片(戈诺卫)(表1) 。此外,强生公司生产的西美瑞韦胶囊(主要有效成分为NS3/4A蛋白酶抑制剂SIM)虽然于2017年8月被CFDA批准在国内上市,但在2018年5月被注销了批号。上述药物中值得一提的是最近批准的由默沙东公司生产的新型EBR/GZR复方制剂(Zepatier),大量的临床研究[8-10]显示其用于GT-1/4的慢性HCV感染者时具有良好的临床疗效及安全性。2017年亚太肝病学会会议上报道的基于亚太人群(共纳入了780例HCV感染者,中国大陆人群占18.7%,肝硬化患者占12.4%)的多中心临床研究显示,Zepatier±RBV治疗后患者的12周持续病毒学应答(SVR)率可达96.9%,联合RBV组的SVR12率为100%(无RBV组为96.9%),药物治疗的不良反应也处于正常范围,显示了Zepatier用于亚洲人群(包含中国人)的良好疗效。此外,尤为重要的是,虽然Zepatier尚未上市定价,但其治疗费用可能较其他DAAs(如SOF的费用约为8.4万元/12周)更为便宜,有助于降低患者的经济负担,具有巨大的临床应用价值[11]。此外,作为中国原研药的丹诺瑞韦(戈诺卫)也于近期获批上市,在两项基于中国患者的临床研究(联合PEG-IFN+RBV)中显示出对GT-1型HCV感染者良好的临床疗效,非肝硬化的大陆患者(GT-1)SVR12率为96%(MAKALU研究,亚太肝病学会会议报道)。
| 图表编号 | XD0037098900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.01 |
| 作者 | 游国琼、王丽、段萌、朱鹏 |
| 绘制单位 | 成都市公共卫生临床医疗中心肝病二科、成都市公共卫生临床医疗中心肝病二科、成都市公共卫生临床医疗中心肝病二科、遂宁市第一人民医院消化内科 |
| 更多格式 | 高清、无水印(增值服务) |