《表1 hGBPs家族成员抗病毒比较》
注:*尚未见报道
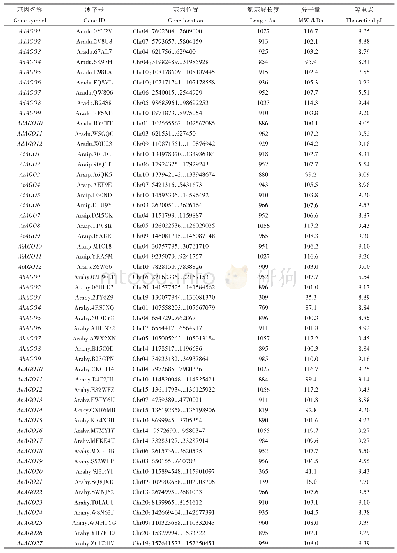
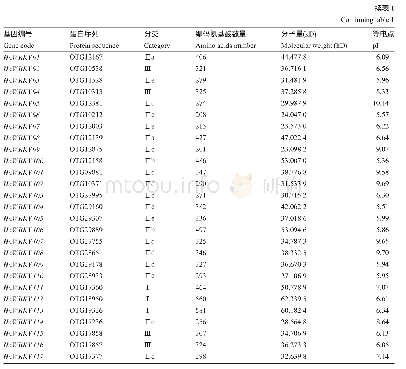
hGBPs基因位于1号染色体(Chromosome 1‐NC_000001.11),其分子量约为67‐73kD,其蛋白结构由N‐末端球状GTP酶活性区、C‐末端螺旋调节区(CTHD)和连接N端与C端的连接区组成[8,15]。其中GTP酶活性区具有GTP水解酶活性,大多数hGBPs蛋白家族成员可以将GTP水解为GDP和GMP,但hGBP5只能将GTP水解为GDP[16]。GT‐Pases家族大多含有CxxxxGKS、DxxG和N/TxPG三个基序,并具有分子开关、GTP结合区和GDP结合区的共同特征(图1)[14,17]。但GBP家族成员结合GTP能力较低,C‐末端大多异戊二烯化,且GTPas‐es的第三个基序N/TxPG缺失,并被替换为精氨酸‐天冬氨酸(RD)基序[6]。其中,hGBP1、hGBP2和hGBP5 C‐末端含具有脂质成分的异戊二烯化基序(CaaX)。CaaX基序是定位于蛋白质的末端4个氨基酸,是法尼基转移酶或香叶酰香叶酰转移酶I的识别序列[18],能够锚定细胞质蛋白到高尔基体[1],但是不同于hGBPs家族中的其他成员,hGBP1中C‐末端CaaS基序是法尼基化的[19]。此外,hGBP1的181~184氨基酸被鉴定为酪氨酸亮氨酸天冬氨酸(TLRD)序列,参与鸟苷酸结合[20]。TLRD序列在hGBP1,hGBP2,hGBP3和hGBP5中保守,但在hG‐BP4,hGBP6和hGBP7中被酪氨酸缬氨酸精氨酸天冬氨酸(TVRD)取代,导致其不能与鸟嘌呤核苷酸结合(表1)[14]。
| 图表编号 | XD0028236100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.01 |
| 作者 | 徐娜、桓晨、张文艳 |
| 绘制单位 | 吉林大学白求恩第一医院艾滋病与病毒研究所、吉林大学白求恩第一医院艾滋病与病毒研究所、吉林大学白求恩第一医院艾滋病与病毒研究所 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式