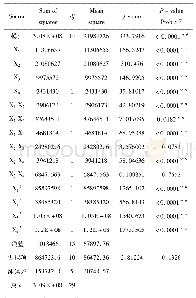
《表1 不同UBD对泛素链的亲和力》
对于无法插入泛素标签的组织、器官等的泛素化蛋白质组的研究中,开发高效的、非标签依赖的泛素化蛋白质纯化方法成为研究重点。其中对泛素信号能够特异性识别的泛素结合结构域(Ubiquitin-binding domain,UBD),成为了主要的目标。2008年,Hjerpe等[2 2]发现串联UBD能够特异性的富集泛素化蛋白质,随后Shi等[2 3]利用这种方法对293T细胞的泛素化蛋白质进行富集,并成功鉴定出了223个泛素化位点。细胞内含有多种类型的UBD,如UBA(UbiquitinAssociated domains),UIM(UbiquitinInteracting motifs),NZF(Npl4 zine finger)等多达20几种。而且不同的UBD对不同泛素链的亲和力不同,可以根据这个特征,来特异性的富集某种类型的泛素链,或者全部类型的泛素链。表1[2 4]列出不同类型UBD对不同泛素链亲和力的情况。该富集方法有独特的优势,不但可以特异性的富集某一种泛素链,而且可以保护泛素链在富集的过程中不被去泛素酶(DUB)降解,有利于一些低水平的泛素化蛋白的富集。但该方法对单泛素化蛋白的亲和力不强。
| 图表编号 | XD00229304000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.25 |
| 作者 | 张嘉麟、李海英 |
| 绘制单位 | 黑龙江大学农业微生物技术教育部工程研究中心、黑龙江大学生命科学学院黑龙江省普通高校分子生物学重点实验室、黑龙江大学农业微生物技术教育部工程研究中心、黑龙江大学生命科学学院黑龙江省普通高校分子生物学重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式