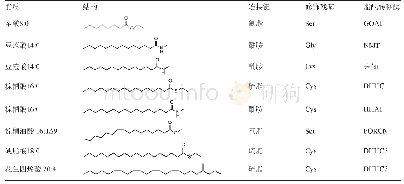
《表1 地表各观测线概况:O-长链脂肪酸修饰在Wnt功能调控中的作用》
胃饥饿素O-酰基转移酶(ghrelin O-acyltransferase,GOAT);N-十四酰转移酶(N-myristoyl transferase,NMT);刺猬酰基转移酶(hedgehog acyltransferase,HHAT);O-棕榈烯酰转移酶porcupine (O-palmitoleoyl transferase porcupine,PORCN);棕榈酰基转移酶DHHC (palmitoyl acyltransf
蛋白质脂酰化与磷酸化、乙酰化和泛素化等修饰一起构成细胞信号响应的核心。通常情况下,细胞中蛋白质的脂酰化可以改变蛋白质的功能、亚细胞定位、稳定性及其与细胞膜和其他蛋白的相互作用[1]。脂酰化来源于不同链长的脂肪酸以多种成键形式与不同氨基酸的侧链基团共价连接。根据羧基连接的原子不同,可以分为O-连接、N-连接及S-连接(表1)。N-脂酰化发生在Lys侧链和N端氨基酸Gly及Cys上。例如在牛和人晶状体中,水通道蛋白(aquaporin-0)的Lys残基被油酸修饰,该修饰可将蛋白靶向到膜结构域[2]。Hedgehog(Hh)蛋白的N端Cys被N-棕榈酰化修饰,该修饰对人癌细胞增殖和侵袭具有重要的作用[3]。蛋白质N端Gly的N-肉豆蔻酰化修饰可发生在正常细胞生长和凋亡过程中,同时该修饰具有广泛的底物,如酪氨酸受体激酶c-Abl(tyrosine-protein kinase c-ABL,c-Abl)、原癌基因酪氨酸蛋白激酶(proto-oncogene tyrosine-protein kinase,c-Src)、BH3相互作用域死亡激动剂(BH3-interacting domain death agonist,Bid)、丝氨酸/苏氨酸蛋白激酶PAK2 (serine/threonine-protein kinase PAK 2,PAK2)和凝溶胶蛋白(gelsolin)等蛋白质并有不同的修饰功能,表明N-肉豆蔻酰化不仅调节蛋白质的定位,而且在调节蛋白质的活性中起着关键作用[4]。S-脂酰化是唯一一种无需酶催化就完全可逆的蛋白质翻译后脂质修饰,是一种普遍存在的调控多种蛋白质性质和功能的机制,在生理过程中起着重要作用。S-脂酰化作用是通过不稳定的硫酯键将长链脂质(最典型的是棕榈酸酯)添加到可溶性和跨膜蛋白的胞内半胱氨酸残基上,增加蛋白质的疏水性,从而影响蛋白质的结构、组装、成熟、运输和功能[5]。O-脂酰化发生在Ser/Thr残基上,而最常见的O-脂肪酸修饰为蛋白质添加16碳和8碳脂肪酸,对分泌蛋白,如Wnt蛋白的成熟和分泌有着重要的作用。Wnt蛋白因其在胚胎发育和干细胞分化中的作用而备受关注[6-8]。现有研究表明,Wnt信号转导对胰岛素抵抗的发生有着重要的影响[9]。本综述将围绕Wnt的O-脂酰化,系统地阐述该类修饰的动态调节、对蛋白质功能的影响及其与疾病之间的关系。
| 图表编号 | XD00207042200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.01 |
| 作者 | 韩笑、杨飞、刘华东 |
| 绘制单位 | 西安交通大学线粒体生物医学研究所、西安交通大学线粒体生物医学研究所、西安交通大学线粒体生物医学研究所 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式