《表2 已报道的GDP-L-岩藻糖增强合成方法》
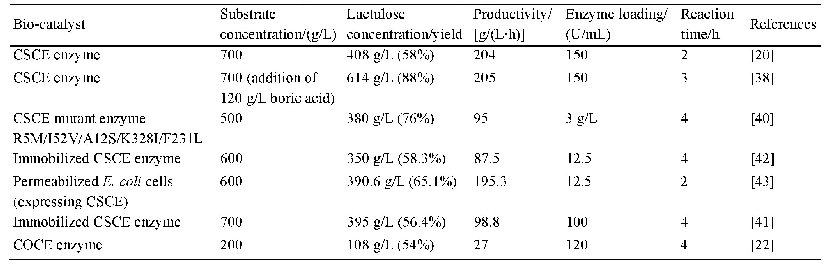
Salvage途径具有技术局限性,原因是L-岩藻糖价格昂贵且难以获得,产业化难度较大[3]。相比较而言,De novo途径不引入L-岩藻糖而以葡萄糖或甘油为碳源合成2’-FL前体GDP-L-岩藻糖。显然,De novo途径的增产需要足够的胞内GDP-L-岩藻糖。为了实现过量积累,多个课题组优化了GDP-L-岩藻糖合成途径。Byun等[21]优化大肠杆菌de novo途径产GDP-L-岩藻糖的产量为55.2 mg/L,共表达了gmd、wca G、zwf三个基因;其中zwf基因属于磷酸戊糖途径,编码负责NADPH再生的葡萄糖-6-磷酸脱氢酶(G6PDH),从而为Wca G催化的反应供应更多的NADPH。Lee等[22]通过在大肠杆菌中表达gmd、wca G、man B、man C获得了170.3 mg/L的GDP-L-岩藻糖含量,是仅表达gmd和wca G对照组的4.4倍,表明man B和man C的过表达较为重要。但继续表达man A并没有进一步增强GDP-L-岩藻糖的产量,表明该基因无需过表达。大肠杆菌的最高GDP-L-岩藻糖积累量为235.2 mg/L,是通过表达gmd、wca G、man B、man C、g6pdh、icd、mae B七个基因实现的,其中G6PDH、Icd、Mae B均负责产生还原力NADPH,十分有利于GDP-L-岩藻糖的积累[23]。Koizumi等[24]利用大肠杆菌和产氨短杆菌Corynebacterium ammoniagenes来混菌发酵,产氨短杆菌具有很强的转化GMP为GTP的能力,GTP被大肠杆菌中的Man C酶催化产生GDP-D-甘露糖,在经过Gmd和Wca G的作用形成GDP-L-岩藻糖,并通过Fuc T催化与N-乙酰-D-乳糖胺(Lac NAc)反应生成终产物Lewis X (也称CD15),这步反应释放的GDP再次通过产氨短杆菌转化为GTP;该混菌体系获得了惊人的18.4 g/L的反应中间体GDP-L-岩藻糖,最终收获了21 g/L的Lewis X,这为2’-FL和3-FL的大量合成提供了一种新思路,但混菌发酵较为复杂,研究难度大,因此尚未见更多的应用报道。3-FL的合成研究较2’-FL少,Jung等[25]通过表达幽门螺杆菌Fut A,实现了3-FL的从头生物合成(de novo),其表达宿主基于大肠杆菌BL21 star(DE3)?L-YA菌株,作者发现以甘油为碳源的3-FL产量要远高于葡萄糖为碳源,并且敲除了可拉酸合成途径的关键基因wca J后菌株?LW-YA中3-FL产量达到了11.5 g/L,摩尔得率0.39 mol/mol,产率0.22 g/(L·h)。Choi等[26]发现BL21(DE3)乙酸产生量更低,因此更适合生产3-FL。结合上述报道,2’-FL和3-FL的生物制备工艺总结为表1,对中间体GDP-L-岩藻糖的增强合成工艺总结为表2。
| 图表编号 | XD00206408400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.25 |
| 作者 | 徐铮、李娜、陈盈利、张雯瑞、朱婉莹 |
| 绘制单位 | 南京工业大学食品与轻工学院材料化学工程国家重点实验室、南京工业大学食品与轻工学院材料化学工程国家重点实验室、南京工业大学食品与轻工学院材料化学工程国家重点实验室、南京工业大学食品与轻工学院材料化学工程国家重点实验室、南京工业大学食品与轻工学院材料化学工程国家重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式