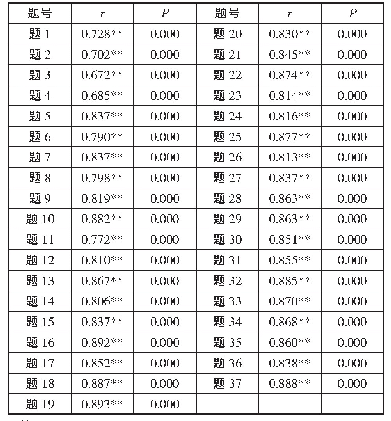
《表1 编制、评价、核准、应用汇总表》
申报注册的“产品技术要求”文件名称采用申请注册/备案的产品名称,编号采用相应的产品注册证号/备案号,其内容由四部分组成,即产品规格型号及划分说明、性能指标、检验方法、术语。性能指标系指医疗器械的功能性、安全性等质量控制要求,须首先选择国家、行业标准的方法。要求(第三类)体外诊断试剂在其技术要求中以附录的形式标明主原料、中间成品、生产加工工艺的技术要求。其编制、评价、核准、应用、修订/变更等要求,见表1。
| 图表编号 | XD00192327100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.25 |
| 作者 | 李宝林 |
| 绘制单位 | 河北省药品医疗器械检验研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式