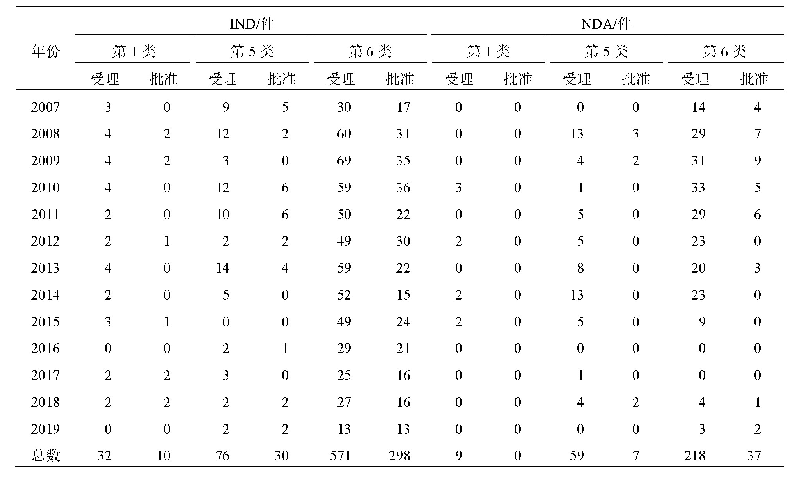
《表4 有条件批准与特例批准的对比[6]》
来源:EMA官网
有条件批准和特例批准都为非正式批准,二者最主要的区别是申请人能否提供完整的数据。在缺乏全面、完整的临床数据的情况下,欧洲EMA认为如果新药申请认定为有条件批准更合适,例如申请人可以在短期内提供该数据,则EMA不会认定产品为特例批准。而对于特例批准的产品,尽管申请人日后履行了所有约定的义务,仍然有极大的可能性无法获得完整的数据。二者主要区别见表4。
| 图表编号 | XD00181774900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.05.15 |
| 作者 | 任晓星、史录文 |
| 绘制单位 | 北京大学药学院、诺思格(北京)医药科技股份有限公司、北京大学药学院、北京大学医药管理国际研究中心 |
| 更多格式 | 高清、无水印(增值服务) |
![《表4 有条件批准与特例批准的对比[6]》](http://bookimg.mtoou.info/tubiao/gif/ZXYZ202009001_03300.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式