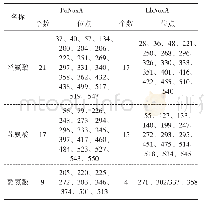
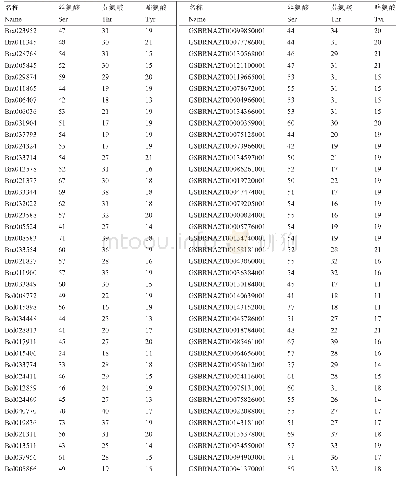
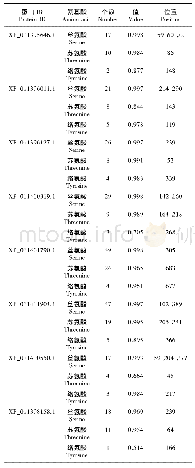
《表4 猕猴桃fasciclin蛋白的磷酸化位点》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《中华猕猴桃fasciclin基因家族生物信息学分析及克隆》
蛋白质磷酸化是指由蛋白质激酶催化的将ATP的磷酸基转移到底物蛋白质氨基酸残基(丝氨酸、苏氨酸、酪氨酸)上的过程,是一种分子开关形式。酶的活性与蛋白磷酸化作用有关[12],磷酸化改变了蛋白表面电荷分布,静电力使构象发生变化,暴露活性位点。使用NetPhos 3.1软件对猕猴桃基因组中fasciclin蛋白的磷酸化位点进行分析,结果发现(表4),丝氨酸磷酸化位点(ser)最多为56个(PSS24547.1),最少为10个(PSS15839.1);苏氨酸磷酸化位点(Thr)最多为26个(PSS24187.1),最少为3个(PSS15839.1);酪氨酸磷酸化位点(Tyr)最多为8个(PSR98800.1),最少为0个(PSR92852.1、PSR89978.1、PSR90069.1、PSR86606.1、PSR86708.1)。结果表明,PSS24547.1、PSS24187.1的丝氨酸、苏氨酸磷酸化位点多,有较强的激活酶活力,而PSS15839.1、PSS15839.1的丝氨酸、苏氨酸磷酸化位点最少,激活酶活力最弱。PSR98800.1的酪氨酸磷酸位点多,除了可以较强激活酶活力之外,还更能促进其与其他蛋白质相互作用而形成多蛋白复合体,PSR92852.1、PSR89978.1、PSR90069.1、PSR86606.1、PSR86708.1没有酪氨酸磷酸位点,激活酶活力和形成复合物的能力最弱。
| 图表编号 | XD00155504800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.10 |
| 作者 | 周婉莹、曲东、张晓娟、张文慧、刘艳飞、张羽 |
| 绘制单位 | 陕西理工大学生物科学与工程学院、陕西理工大学生物科学与工程学院、陕西理工大学生物科学与工程学院、安康市农业科学研究院、西北农林科技大学园艺学院、陕西理工大学生物科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |