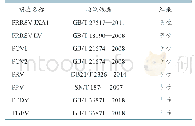
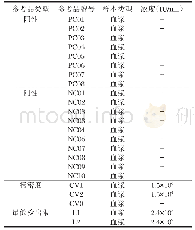
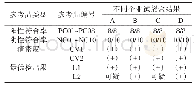
《表1 国家药监局批准的SARS-CoV-2病毒核酸检测试剂》
SARS-CoV-2基因组测序的完成为发展基于PCR技术的病毒核酸检测奠定了基础。理论上,低至几个拷贝的核酸通过扩增都可以被检测出,再加上PCR技术相对成熟,易于开发出相应的试剂盒,疫情暴发初期,临床上的生化检测基本上都依靠实时荧光定量PCR(RT-PCR)。2020年2月初国家药监局紧急批准了7个SARS-CoV-2检测试剂盒。随后,荧光逆转录环介导等温扩增(RT-LAMP)、依赖核酸序列扩增(NASBA)、重组酶聚合酶扩增技术(RPA)和基因芯片等基于PCR的技术也迅速出现[21]。截至2020年3月13日,国家药监局批准了11种核酸检测试剂盒(表1)。为了满足大量患者的检测需求,正在尝试建立基于RT-PCR的高通量检测模型[22]。
| 图表编号 | XD00135121200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.04.08 |
| 作者 | 陈沐寒、陈亚雄、韩月、刘东旭、房建国 |
| 绘制单位 | 山东大学口腔医学院口腔医院正畸科、山东大学山东省口腔组织再生重点实验室、山东大学山东省口腔生物材料与组织再生工程实验室、兰州大学化学化工学院功能有机分子化学国家重点实验室、中国科学院近代物理研究所甘肃省空间辐射生物学重点实验室、兰州大学口腔医学院、山东大学口腔医学院口腔医院正畸科、山东大学山东省口腔组织再生重点实验室、山东大学山东省口腔生物材料与组织再生工程实验室、兰州大学化学化工学院功能有机分子化学国家重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式

![表1 人细小病毒B19核酸检测试剂国家参考品PCR扩增及测序引物[6]](http://bookimg.mtoou.info/tubiao/gif/YXYQ202012003_01000.gif)
