《表1 O2在ILs中的溶解度》
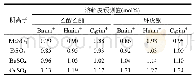
2002年,Anthony等[69]首次报道了283.2~323.2 K和1.0~13.0 bar时,O2在[Bmim][PF6]中的溶解度,并比较了O2与CO2、CH4等气体在[Bmim][PF6]中的溶解性能.结果显示,压力对[Bmim][PF6]吸收O2的容量有很大影响:当323.2 K和1.0 bar时,O2在[Bmim][PF6]中的溶解度仅为4.8×10–4mol O2·(mol IL)–1,而当压力升至12.0bar时,O2的溶解度增加到8.4×10–3mol O2·(mol IL)–1.实验结果还表明,相同条件时,O2、CO2、CH4、C2H4和C2H6在[Bmim][PF6]中的亨利常数大小顺序为:O2>>CH4>C2H6>C2H4>CO2(亨利常数越大,溶解度越小).上述结果引起了研究者的兴趣,Maurer课题组[70]、Costa Gomes课题组[71]和Prausnitz课题组[72]通过实验测定了O2在[Bmim][PF6]中的溶解度(见表1).Shah等[73]还采用蒙特卡罗模拟(Monte Carlo Simulations)研究了温度对O2在[Bmim][PF6]中的溶解度影响,结果表明O2的溶解度随温度升高而略有降低.另外,通过分析表1的数据发现,O2在常规ILs中的溶解度主要受温度和压力等外因的影响,一般而言,O2的溶解度随压力升高而增加,随温度升高而降低.然而,Anthony等[70]和Prausnitz课题组[72]却发现温度升高有利于[Bmim][PF6]溶解O2,这归因于实验装置和方法的不同.实验装置与方法的差异也增加了O2溶解度测定的误差.例如,当323.2 K和0.9 bar时,Prausnitz课题组[72]、Husson-Borg等[74]和Jacquemin等[75]测得O2在[Bmim][BF4]中的溶解度分别为5.7×10–3、2.3×10–3和5.8×10–4mo O2·(mol IL)–1.因此,后续研究者不仅需要开展更多工作对已有实验结果进行验证,而且还要对阴阳离子结构对ILs吸收O2性能的影响及规律进行深入研究与总结.
| 图表编号 | XD00133282700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.04.20 |
| 作者 | 刘佳佳、许映杰 |
| 绘制单位 | 绍兴文理学院化学化工学院、绍兴文理学院化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式