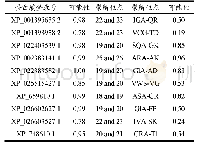
《表5 CBM67家族真核α-L-鼠李糖苷酶CBM分子对接模型能量分析数据》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《真核α-L-鼠李糖苷酶的碳水化合物结合结构域功能架构分析》
对12个CBM蛋白模型进行对接(表5),得到的-Cdocker Energy的范围为-11.9到-2.62,-Cdocker Interaction Energy的范围为10.03到20.00。说明以L-鼠李糖配体作为底物时,这12个蛋白模型都与配体有良好的结合效果,获得了构象稳定的对接复合物,可用于后续的对接结果分析中。选择结合能最小、结构最稳定的构象生成12个2D对接作用图。选取4个2D对接作用图进行展示(图5),结果表明L-鼠李糖配体能够结合到CBM的活性空腔内,且活性空腔内的L-鼠李糖都能与CBM的ASP、ALA、GLN、ASN等氨基酸残基形成范德华力作用,且L-鼠李糖上的氧原子的都能与196、197号(以图3的氨基酸序列为基准)有效结合位点附近的CBM氨基酸残基形成至少一个氢键。故推测196、197号氨基酸为提高L-鼠李糖与α-L-鼠李糖苷酶结合稳定性的功能位点。证明CBM通过与配体之间的各种作用力(氢键和范德华力)来提高复合物的稳定性,进而提高酶分子对不溶性底物的亲和力以促进酶降解底物的催化活性的提升。
| 图表编号 | XD00118287700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.20 |
| 作者 | 蔡雨晨、曹博瀚、巩建业、李利君、倪辉 |
| 绘制单位 | 集美大学食品与生物工程学院福建省食品微生物与酶工程重点实验室、集美大学食品与生物工程学院福建省食品微生物与酶工程重点实验室、集美大学食品与生物工程学院福建省食品微生物与酶工程重点实验室、集美大学食品与生物工程学院福建省食品微生物与酶工程重点实验室、集美大学食品与生物工程学院福建省食品微生物与酶工程重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |

![表5.CBM65对酯酶释放油松中乙酸速率的影响[(μg·h)/m L]](http://bookimg.mtoou.info/tubiao/gif/WSXB202012007_05700.gif)