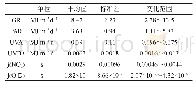
《表2 CDE公示品种申请适用范围统计(统计时间:2018年6月)》
注:首仿品种不属于食药监药化管[2017]126号中规定的优先审评审批范围品种,但在CDE公示品种的“申请优先审评审批理由”中列有“首仿”,故此次把首仿品种也一并列入
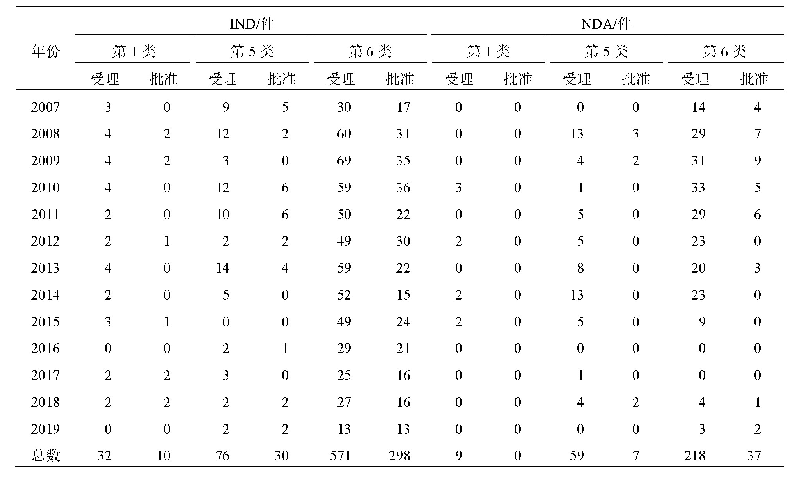
根据[2017]126号文[1]内容,可申请优先审评审批的范围加上首仿品种一共有19项。在已公示的品种中,以“使用先进制剂技术、创新治疗手段、具有明显治疗优势的药品注册申请”(即[2017]126号文中的1.3类)理由申请并获公示的优先审评审批品种数量最多,共有126件;其次是“儿童用药品”(即2.6类),共有71件;接着是“申请人在美国、欧盟同步申请并获准开展药物临床试验的新药临床试验申请;在中国境内用同一生产线生产并在美国、欧盟药品审批机构同步申请上市且通过了其现场检查的药品注册申请。”(即1.5类),共有68件,从中可看出改良型新药、儿童药以及与美欧同期申报或共线的品种在申请范围类别中受关注最多,且申请数量和公示数量最多。另外,“转移到中国境内生产的创新药注册申请”(即1.2类)、“在重大疾病防治中具有清晰的临床定位的中药(含民族药)注册申请”(1.6类)、“肺结核”(2.2类)、“老年人特有和多发的疾病”(2.7类)、“在仿制药质量一致性评价中,需改变已批准工艺重新申报的补充申请”(3.1类)、“在公共健康受到重大威胁情况下,对取得实施强制许可的药品注册申请,予以优先审评审批。公共健康受到重大威胁的情形和启动强制许可的程序,由国家卫生计生委会同有关部门规定。”(3.4类)这六类申请数量较少,接近于零,说明国内医药企业对这些方面的关注较少,或者说没注意到其在优先审评审批方面的优惠政策,未进行申请。具体情况见表2。
| 图表编号 | XD00104883000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.25 |
| 作者 | 梁润敏、杨悦 |
| 绘制单位 | 沈阳药科大学工商管理学院、沈阳药科大学工商管理学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式