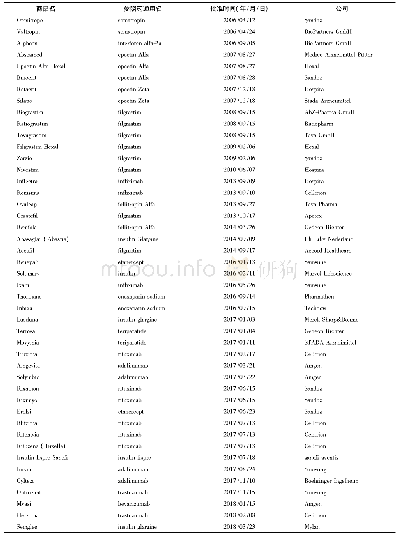
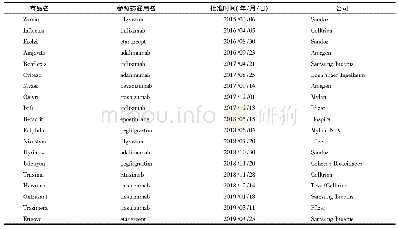
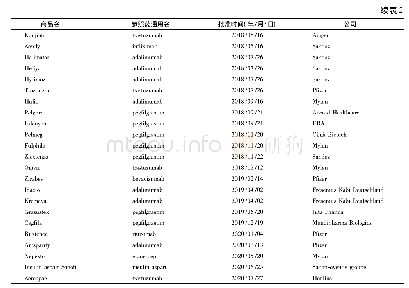
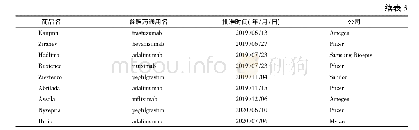
《表2 2014年1月—2018年11月NMPA批准的1类生物创新药》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《2014至2018年我国自主研发并获准上市的1类新药概述》
数据来源:NMPA,CDE,Pharmadigger数据库
2014年—2018年11月,NMPA(包括原CFDA)共批准5个国产1类生物创新药(见表2),数量上少于1类化学创新药,且大多为预防用生物制品(疫苗);此外,2018年初直至目前,尚无1类生物创新药获批。不过,“沉寂”之后也许就会迎来“蓄势待发”:生物大分子药物除了疫苗外,还包括蛋白、抗体、细胞治疗产品、核酸药物、基因治疗产品等,尤其是单抗和CAR-T,在全球掀起了一股研发热潮,国内许多药企也在这些领域积极展开布局。例如,南京传奇生物科技有限公司研发的细胞疗法产品(LCAR-B38M CAR-T细胞自体回输制剂)是国内首个开展临床试验的CAR-T产品;信达生物研发的重组抗VEGF人源化单克隆抗体注射液已进入Ⅲ期临床研究阶段[10];还有多个1类生物创新药正处于申请上市阶段,其中治疗用生物制品的比重显著增加,将会在下文列表介绍。因此,尽管过去5年获批上市的1类生物创新药数量少、品类单一,但笔者相信,以目前的良好发展势头,未来5年将会百花齐放、全面收获。
| 图表编号 | XD0087300900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.07.15 |
| 作者 | 杨臻峥、孙友松、魏利军、吴小涛、乔思邈、郑晓南 |
| 绘制单位 | 中国药科大学《药学进展》编辑部、上海递鸽医药科技有限公司、哈药集团股份有限公司、南京济群医药科技股份有限公司、中国药科大学中药学院中药药理与中医药学系、中国药科大学《药学进展》编辑部 |
| 更多格式 | 高清、无水印(增值服务) |