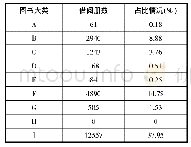
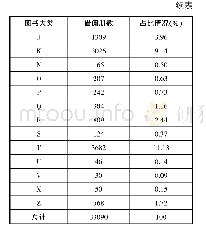
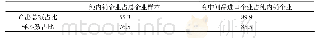《表1 美国上市前和上市后指导原则占比分析》
注:部分指导原则同时适用于上市前和上市后监管。
美国的医疗器械监管起步早,经过长期的摸索形成了一套成熟的监管模式[8],在此期间积累了丰富的监管经验。美国对医疗器械监管中也以指导原则作为技术支撑文件[9],其最早的指导原则可追溯至1975年。截至2020年3月,美国食品和药物管理局(FDA)发布的医疗器械指导原则共计614份[10],涵盖了从上市前审批到上市后监管的产品全生命周期内容,其中有547份指导原则为发布稿,67份为征求意见稿。通过不同检索词对美国上市前和上市后指导原则占比进行汇总分析,见表1。通过不同检索词对美国2000年后发布的通用类和产品类医疗器械指导原则进行汇总,发现上市前通用类指导原则数量为112项,占比58.9%、产品类指导原则数量为78项,占比41.4%;上市后通用类和产品类指导原则数量各为14项,分别占比50%。经分析,美国医疗器械指导原则内容主体以上市前监管规范为主,同时兼顾了上市后监管内容;结构方面以通用类指导原则为主,产品类指导原则以冠脉支架、血管内导管等高风险植入类居多。
| 图表编号 | XD00227744600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.10 |
| 作者 | 李耀华、塔娜 |
| 绘制单位 | 国家药品监督管理局医疗器械技术审评中心、国家药品监督管理局医疗器械技术审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式