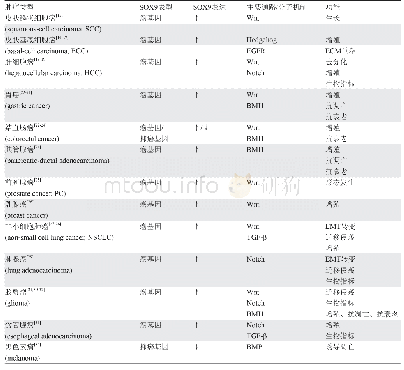
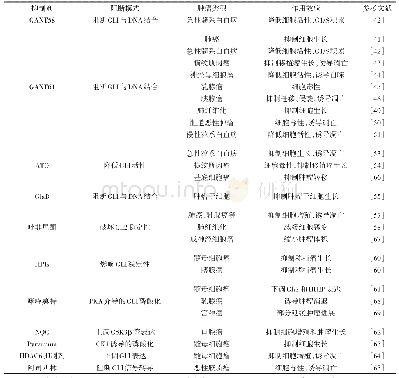
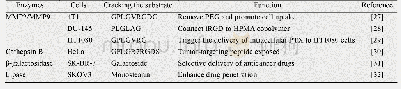
《表4 肿瘤部位各种表达异常的酶及其药物递送系统中的应用》
众所周知,肿瘤微环境是一种非常丰富的环境,在肿瘤微环境中多种酶过度表达,肿瘤细胞外及肿瘤细胞内过度表达的酶如基质金属蛋白酶(MMP2和MMP9)、酯酶、α-淀粉酶、组织蛋白酶B(Ca B)等[23],p H值也低于正常细胞环境,并且肿瘤部位新生血管也多于正常部位,这些都是肿瘤组织的主要特征。表4中总结了肿瘤部位各种表达异常的酶及其药物递送系统中的应用。Ni等[24]开发出了一种多药耐药性(MDR)的多肽前药(m PEG–peptide–DOX,MSNPs)。其中m PEG延长了体内循环时间,一旦纳米药物到达肿瘤部位,会在高MMP2酶的作用下脱去m PEG,暴露出特异性靶向多肽T10 (CGGHAIYPRH),通过受体介导的内吞作用将DOX传递到细胞中。最后,DOX与T10肽之间的腙键在酸性条件下被裂解,活性的DOX被释放出来摧毁肿瘤细胞。实验结果证明p H 7.4时DOX在48 h释放了30%,当p H 5.5时DOX在相同时间内释放90%,证实了胞内的快速响应。MSNPs在MCF-7/ADR细胞中表现出很好的细胞毒性,IC50值为34.33 mmol/L。共聚焦观测到MSNPs对癌细胞的DNA损伤程度是MISNP和DOX处理的1.5倍和1.7倍。动物实验中也进一步证实MSNPs的肿瘤抑制率(TIR)为72.09%,分别比游离DOX、T10-DOX和MISNP高2.38、1.35和1.19倍。Cun等[25]利用氯沙坦可以降低肿瘤部位的胶原蛋白,设计出了结合氯沙坦的双响应抗癌纳米颗粒DOX-Au NPs-GNPs。该纳米粒的最大特点是联合使用DOX-Au NPsGNPs和氯沙坦来消耗肿瘤细胞外胶原蛋白,进一步提高了抗癌纳米药物在肿瘤部位的渗透性。并且在肿瘤部位高表达的MMP2及酸性条件触发下,纳米粒可从117.8 nm以上缩小到50.0 nm以下,并释放DOX,尺寸的变小更有利于向肿瘤细胞内扩散,进而达到更好的抗肿瘤效果。Zhang等[26]设计了一种一体化的荧光成像引导化疗和光热疗法(PTT)结合近红外光(NIR)能有效杀死肿瘤细胞的共轭纳米粒子(IR820-PTX),其载药量高达95.7%。该纳米粒经过肿瘤细胞内化后,在p H和酶的作用下酯键裂解,紫杉醇(PTX)和吲哚菁绿(IR820)同时释放。此外,可通过NIR刺激IR820产生的荧光成像来指导联合治疗。因此,IR820-PTX能为有效的PTT、化疗和成像组合提供一种“多合一”治疗平台。
| 图表编号 | XD00225184300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.25 |
| 作者 | 禄秀娟、郭鑫昊、万冬、潘杰 |
| 绘制单位 | 天津工业大学化学与化工学院、天津工业大学化学与化工学院、天津工业大学化学与化工学院、天津工业大学化学与化工学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式