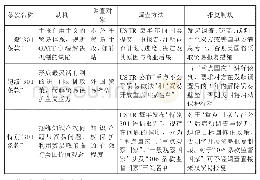
《表1 修订前后的《基本原则》条款简要对比》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《IMDRF组织《医疗器械安全和性能的基本原则》内容简介及思考》
本次《基本原则》的修订,在内容、结构和顺序上均进行了调整(见表1)。覆盖产品范围由非体外诊断医疗器械扩大到所有医疗器械,重点突出应在“全生命周期”和“质量管理体系”两个维度下考虑医疗器械安全和性能应满足的要求。各条款按照类别属性重新进行了归类和细化,数量从原来的65条增加至78条,覆盖更加全面,表述更加严谨,内容更加丰富,指向性更明确,详细描述了制造商在医疗器械设计和生产过程需考虑的风险和产品性能研究应满足的要求。
| 图表编号 | XD00218808300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.30 |
| 作者 | 孙嘉怿、吴琨、刘斌、张世庆 |
| 绘制单位 | 国家药品监督管理局医疗器械技术审评中心、国家药品监督管理局医疗器械技术审评中心、国家药品监督管理局医疗器械技术审评中心、国家药品监督管理局医疗器械技术审评中心 |
| 更多格式 | 高清、无水印(增值服务) |