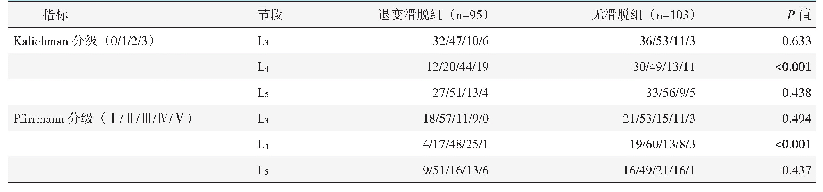
《表1 椎间盘退变后主要促炎因子的变化》
炎症反应通常被认为是机体应对感染或组织损伤后的一种病理过程,越来越多的证据表明炎症是IDD进程中的关键因素[16~17]。随着IDD进展,退变椎间盘中各种促炎细胞因子的水平显著增加,包括白细胞介素-1α(interleukin-1α,IL-1α)、IL-1β、IL-6、IL-17和肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)等[18~25](表1),这些炎症因子在局部产生自身免疫炎症反应并使椎间盘ECM的分解代谢增强,从而导致椎间盘功能紊乱和结构改变。相关研究表明,在变性椎间盘中IL-1β的水平增加,且随着IDD的严重程度而增加;IL-1β不仅能直接抑制ECM合成,而且还形成一个正反馈回路,刺激其他炎症介质的释放和基质金属蛋白酶的合成,进而导致椎间盘局部分解代谢增强[16]。体外实验证实,用IL-1β刺激人NP和AF细胞后,IL-6、IL-8和IL-17的水平均显著增加。可见,IL-1β可通过促进IL-6、IL-8和IL-17的释放而充当炎症级联事件的关键引发剂[18]。Chen等[19]用酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)方法检测了腰椎间盘突出症患者的血清IL-21浓度,发现其较椎间盘未突出患者明显增加。Gorth等[20]通过研究IL-1在年龄相关IDD中的作用发现,给予小鼠IL-1α/β双基因敲除(IL-1KO)后,血液中炎症因子γ干扰素(interferon-γ,IFN-γ)、IL-5和IL-15的浓度显著降低。重要的是,这些炎症介质参与椎间盘细胞衰老进程。Markova等[21]研究发现,TNF-α增加了体外培养牛椎间盘细胞中SA-β-gal染色阳性细胞的数量,并导致ECM从合成代谢转变为分解代谢。同样,在用TNF-α和IL-1β处理大鼠NP细胞后,SA-β-gal阳性细胞数量也显著增加[22]。此外,一些炎症因子如IL-1β、IL-6、TNF-α等对长入椎间盘的窦椎神经末梢产生炎性刺激,进而引发神经根性疼痛的临床症状[4]。以上研究表明,炎症因子是强大的促细胞衰老因子,是导致IDD的关键因素之一,也是导致慢性腰背痛的重要原因。
| 图表编号 | XD00209016800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.28 |
| 作者 | 张广智、武作龙、贺学岗、高一诚、郭旭东、王以典、刘明强、朱大学、康学文 |
| 绘制单位 | 兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室、兰州大学第二医院骨科、甘肃省骨关节疾病研究重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式