《表1 CRISPR系统在微生物中的分布情况》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《食源性致病菌耐药性与成簇的规律间隔短回文重复序列系统关联性研究进展》
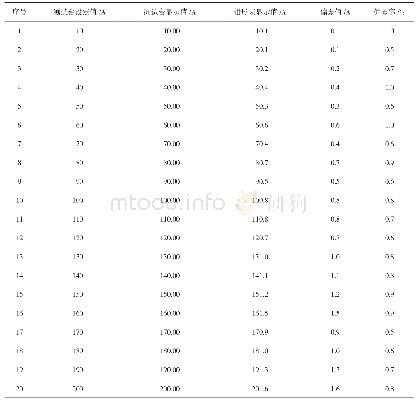
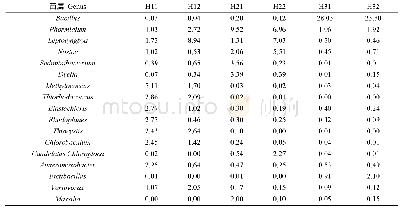
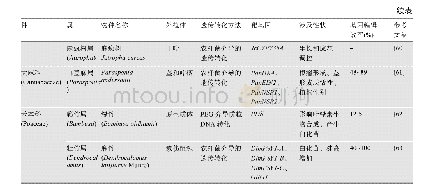
研究发现细菌和古细菌中存在一种抵抗外源遗传物质入侵的序列,其被命名为成簇的规律间隔短回文重复序列(clusterd regularly interspaced short palindromic repeats,CRISPR),直到目前,CRISPR-Cas系统已经发展到在众多学科中拥有多种应用,包括在基因编辑、基因组工程和治疗遗传疾病方面的应用[4]。70%的细菌、古细菌(表1)[5]拥有这种抵御外来入侵噬菌体、病毒、质粒的机制,成簇的规律间隔短回文重复序列由相同的重复序列(direct repeats,DR)与间隔序列(spacer,S)交替构成;除此以外,还包括前导序列(proto-spacer adjacent motifs,PAMs)和cas基因组(图1),作用分别为引导核酸剪切酶进入指定剪切位置和核酸酶的表达基因,对复合体实行免疫作用[6?8]。cas基因目前也是作为划分CRISPR类型的一大标准,CRISPR-Cas系统存在Ⅰ型、Ⅱ型、Ⅲ型,而这3种类型的系统依赖于cas1与cas2 2个基因,它们功能在于将外源基因整合至自身间隔序列中发挥剪切效应[9,10]。这3种类型的特征基因分别是cas3、cas9、cas10,目前Ⅱ型CRISPR-Cas9系统凭借操作简单、成本低的剪切结合方式,其基因编辑效率远远高于锌指核酸内切酶(zinc finger nucleases,ZFN)和类转录激活因子效应物核酸酶(transcription-like activator effector nuclease,TALEN)编辑手段,成为运用范围最广的第三代基因编辑手段[11]。另外,基于CRISPR-Cas12与CRISPR-Cas13为基础的检测手段,可以快速检测新型冠状病毒(COVID-19)[12],若是将此技术应用于食源性致病菌的检测中,具有良好的应用前景。目前耐药基因广泛存在于不同食源性致病菌中,基于CRISPR-Cas系统溯源性情况,验证存在阻碍基因水平转移(horizontal gene transfer,HGT)的现象[13,14]。尽管具有阻遏效应,但是相同的耐药基因还是会出现在不同菌种的基因序列中[15],对于不同菌种间相同耐药基因溯源问题,目前也值得进行深入研究。
| 图表编号 | XD00207295000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.25 |
| 作者 | 金姗姗、王义哲、赵喜红 |
| 绘制单位 | 武汉工程大学环境生态与生物工程学院、武汉工程大学环境生态与生物工程学院、武汉工程大学环境生态与生物工程学院 |
| 更多格式 | 高清、无水印(增值服务) |