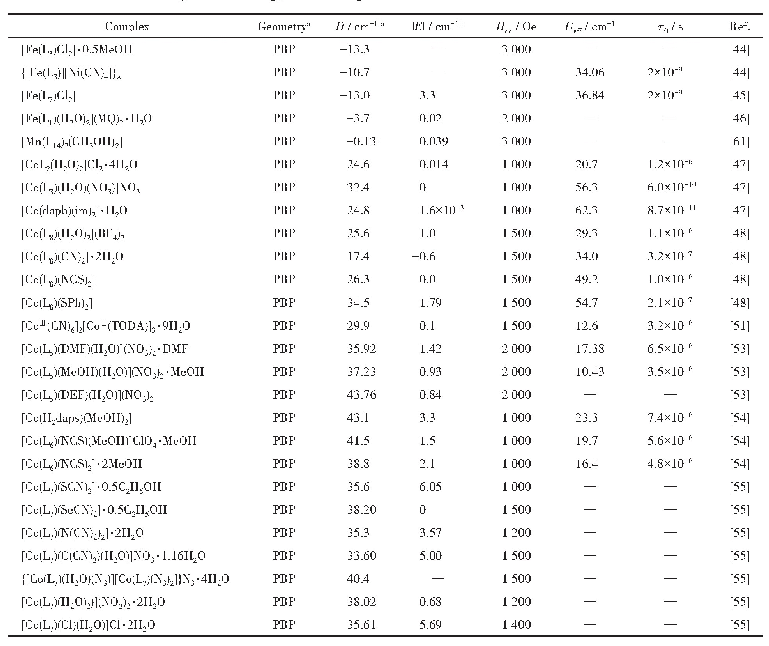
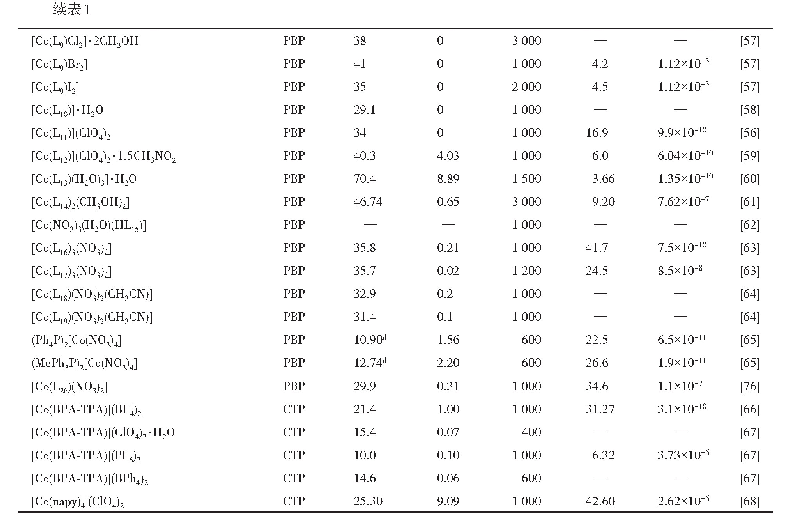
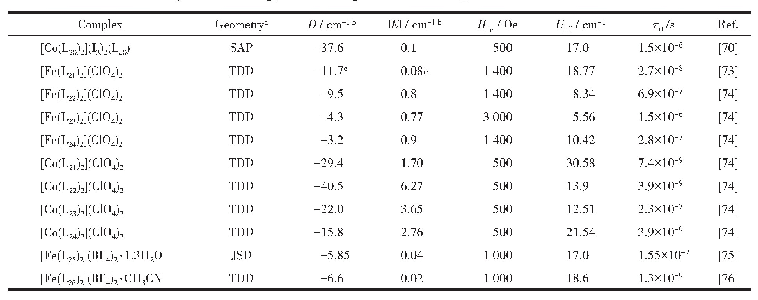
《表3 常见金属离子半径与对应配位形式》
根据反应式(3)和(4),理论上与Na+半径相近的阳离子均可与方沸石进行交换,表现为离子交换作用或吸附作用。常见的几种离子半径及其配位形式列于表3[49]。据此性质,方沸石主要应用于污水处理领域,对Cu2+、Ni2+、Pb2+、Zn2+、Cd2+等离子均有一定的吸附作用[50-53]。从吸附效果看,方沸石的离子吸附具有选择性:采用珍珠岩合成的方沸石在298 K~333 K范围内,对Pb2+、Cu2+、Zn2+、Ni2+4种离子的吸附能力依次减弱[50],由表3可见,Cu2+、Zn2+、Ni2+半径与Na+相比较小,不易留存于方沸石孔道中,而Pb2+半径相对较大,故易留存。采用化学试剂合成的方沸石在pH=6时对Pb2+的最大吸附量可达14.5 mg/g[52]。此外,方沸石对某些阴离子及有机物分子同样具有吸附能力:天然方沸石矿物经提纯后对于处理SO42-、F-等阴离子同样具有良好效果[54-55],钡改性后的方沸石室温条件下对硫酸根的最大吸附量为13.7 mg/g[56],以高岭石和稻壳灰合成的方沸石室温下对苯酚的最大吸附量为14.0 mg/g[11]。
| 图表编号 | XD00200769000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.10.01 |
| 作者 | 刘昶江、马鸿文、高原、顾晓滨 |
| 绘制单位 | 河北地质大学宝石与材料工艺学院、中国地质大学(北京)材料科学与工程学院、中国地质大学(北京)材料科学与工程学院、河北地质大学宝石与材料工艺学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
![表2 三价稀土金属的离子半径[59]及其M3+/2+和M4+/3+的氧化还原电势[33,46,60]](http://bookimg.mtoou.info/tubiao/gif/JBXK202011004_184500.gif)