《表3 白蛋白与华法令钠结合的HPLC出峰积分表》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《一步离子交换层析从Cohn组分Ⅴ上清液中分离人血清白蛋白》
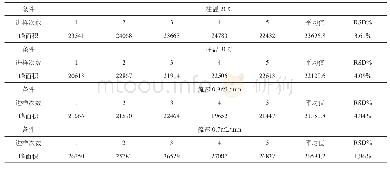
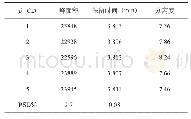
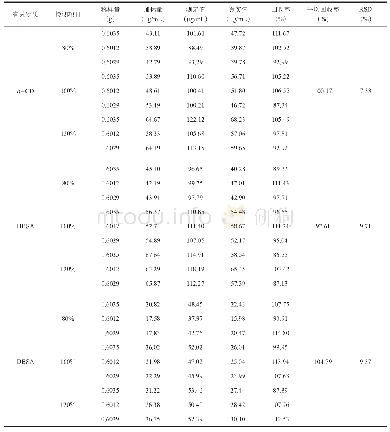
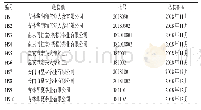
对于从乙醇-水溶液中分离蛋白质来说,一个重要问题是分离纯化的蛋白质是否还有原来的生物学活性。乙醇虽然具有很好的亲水性,但也是一种有机溶剂,而有机溶剂的存在则有可能影响蛋白质的结构。为解决这一问题,本工作用圆二色光谱和荧光光谱表征了分离产物的光学特性,并与商品人血清白蛋白进行比较,表明了两者的一致性,证明这个分离过程没有引起HSA结构的变化。这是因为乙醇用于血浆蛋白质的沉淀分离已经有几十年的历史,人血清白蛋白只有一条肽链,分子间有17对二硫键,是一个结构紧凑不易变性的蛋白质。但在层析条件下是否发生变性,还需要实验证明。为此,本研究不仅测量了蛋白质的二级和三级结构,还进行了白蛋白与药物结合活性的测量。人血清白蛋白含两个主要的药物结合位点[21],分别位于IIA和IIIA域的洞穴内。药物结合位点I是一个正电荷残基包围的口袋,口袋内壁由疏水氨基酸构成(Lys-199,Arg-218,His-242)[21,22]。华法令钠是结合位点I的特征药物。鉴于白蛋白在313nm几乎无吸收,而华法令钠在313 nm有最大吸收[16]。通过分析白蛋白与华法令钠在313 nm波长下的色谱峰图,从而确定白蛋白与小分子药物结合率(图6)。人血清白蛋白的结合功能与其空间构象有很大关系,通过对HPLC峰面积积分处理,结果显示从组分V上清中纯化的人血清白蛋白(4.17%)与人血清白蛋白制品(4.67%)对小分子的结合率基本一致(表3)。
| 图表编号 | XD00198045200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.01 |
| 作者 | 向杰、张松平、张贵锋、罗坚、余蓉 |
| 绘制单位 | 四川大学华西药学院生物技术药物学系靶向药物与释药系统教育部重点实验室四川省植物来源工程实验室和四川省小分子药物精准化工程技术研究中心、中国科学院过程工程研究所生化工程国家重点实验室、中国科学院过程工程研究所生化工程国家重点实验室、中国科学院过程工程研究所生化工程国家重点实验室、四川大学华西药学院生物技术药物学系靶向药物与释药系统教育部重点实验室四川省植物来源工程实验室和四川省小分子药物精准化工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |