《表3 因子共线性诊断:S掺杂Fe-NC单原子催化剂氧还原机理研究》
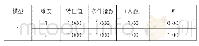
我们对催化剂活性位点的氧还原催化活性进行具体的研究.根据Li等[10]的研究,氧气在Fe-NS催化剂表面的还原反应通过四个电子反应步骤生成水.因此,我们主要针对这一机理进行研究.在反应自由能的计算过程中,因为VASP计算双原子气体分子的振动频率不够准确,因此我们采用Norskov等[17]应用的方法,用氧还原反应的标准电极电势减去其他三项反应步骤的自由能,得到第一步反应的反应自由能:O2+*+(H++e-)→*OOH.氧还原反应的平衡电极电势为4.92 V,为了显著表示氧还原反应的过电位,我们计算了U=1.23V时的反应自由能.氧还原反应过程中涉及到的反应中间体有*OOH,*O和*OH (*表示中间体在催化剂表面吸附).氧还原反应自由能图如图4,反应过程中涉及到的反应中间体吸附构型如图5,具体的反应自由能能量如表3所示.在Fe N4催化剂表面,氧气以end-on构型稳定吸附在铁原子的顶位上,溶液中一个质子-电子对转移到氧气分子上,质子与远端的氧原子连接,形成OOH*中间体,该步反应的自由能为-0.27 e V,是自发进行的.接下来OOH*中间体接收一对质子-电子,生成一个水分子和吸附的氧原子O*,该步反应的反应自由能为-0.91 e V,同样是自发进行的,表明一旦氧气吸附在Fe N4表面,就会自发生成O*和一个水分子.接下来O*经过质子-电子反应生成OH*,需要克服0.48 e V的能量.最后,一个质子转移到O原子上生成一个水分子,需要克服0.70 e V的能量,最后一步反应是氧还原反应的电势控制步骤,表明在Fe N4催化剂上氧还原反应的过电位是0.70 V.在Fe NS1a和活性位点,氧还原反应的电势控制步骤同样是最后一步,过电位为0.79 V,表明引入一个S原子之后不仅没有降低氧还原反应的过电位,反而使得过电位增加.在Fe NS2催化剂表面,由于OOH*的吸附能力较弱,初步反应需要较大的能量,为0.21 e V,氧还原反应的电势控制步骤是OH*+(H++e-)→*+H2O(l),过电位是0.82 V.在Fe NS3催化剂表面,电势控制步骤与Fe N4表面一样,过电位是0.77 V.在Fe NS4催化剂表面,电势控制步骤同样为最后一步,过电位是0.68 V,在五种研究的催化剂中,其过电位是最低的.对比巴德电荷分析,Fe NS4催化剂中,Fe的价态是最高的,表明Fe较高的氧化态可以降低反应中间体*OH的吸附.
| 图表编号 | XD00195240400 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.15 |
| 作者 | 鲁效庆、曹守福、魏晓飞、李邵仁、魏淑贤 |
| 绘制单位 | 中国石油大学材料科学与工程学院、中国石油大学材料科学与工程学院、中国石油大学材料科学与工程学院、中国石油大学材料科学与工程学院、中国石油大学材料科学与工程学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式