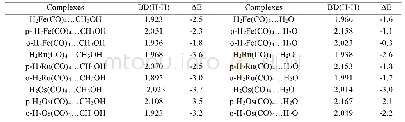
《表2 WT_TBM和P197S_TBM的结合自由能和组分(kcal/mol)》
采用MM-PBSA计算WT_TBM体系和P197S_TBM体系的ΔGbind。由表2可知,WT_TBM体系的结合自由能为-4.18 kcal/mol,突变后P197S_TBM体系的结合自由能为-8.70 kcal/mol,ΔGbind为负值,说明2种复合物均自发形成键合作用。比较二者结合过程中释放的自由能可知突变体系中的结合力更强,说明P197S位点突变促进了ALS与苯磺隆结合。从2个体系的能量组成来看,WT_TBM体系结合的主要驱动力来自静电能(ΔEele=-134.68 kcal/mol)、范德华力能(ΔEvdw=-51.61 kcal/mol)和非极性溶剂能(ΔGnopolar=-33.27 kcal/mol),而溶剂化能和极性溶剂能不利于野生体系结合的力量。突变体系的促结合能量与抑制结合能量类型均相同,促结合能量项数值均比野生型能量分项数值略大,抑制结合能量略小,故表现为数值更低的总结合自由能。
| 图表编号 | XD00186110000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.30 |
| 作者 | 赵奇、邓培渊、郭运宏、陈丽培、罗青 |
| 绘制单位 | 郑州师范学院生命科学学院、郑州师范学院生命科学学院、郑州铁路职业技术学院建筑工程系、郑州师范学院生命科学学院、郑州师范学院生命科学学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式