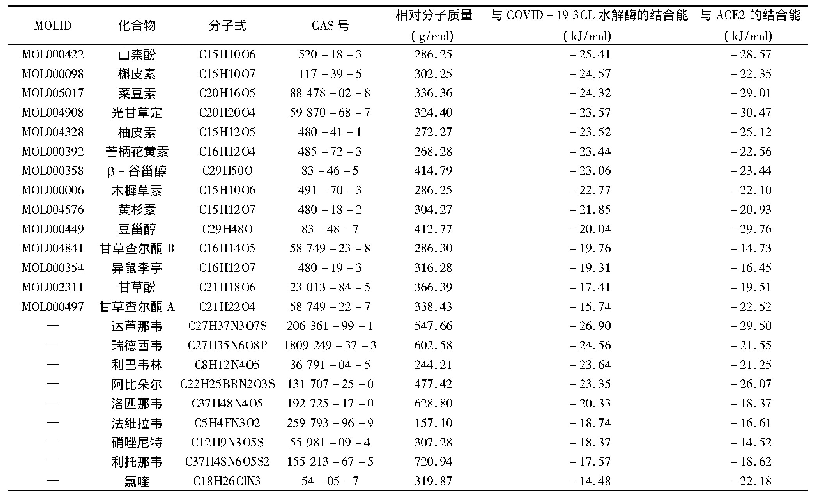
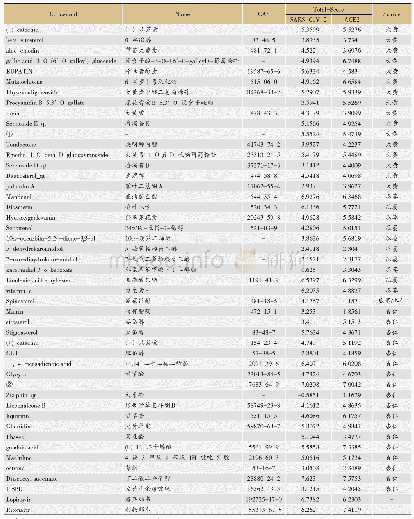
《表1 不同研究团队报道的SARS-Co V-2 S蛋白中与ACE2的结合位点》
冠状病毒的组织嗜性由S蛋白与宿主细胞上受体的相互作用决定。三维结构解析显示SARS‐Co V‐2与SARS‐Co V S蛋白有着类似的高级结构[17,28,29]。Walls A C研究小组的体外结合实验显示人源ACE2与SARS‐Co V‐2和SARS‐Co V S蛋白结合能力没有差异[24]。而Shang J团队的SARS‐Co V‐2 S蛋白受体结合域(RBD)与ACE2复合物结构解析以及蛋白互作实验研究显示,SARS‐Co V‐2S蛋白与受体ACE2的结合能力强于SARS‐Co V[30]。Tai W以及Wang Q团队研究也表明SARS‐Co V‐2 RBD与人源ACE2的结合能力强于SARS‐Co V[31,32]。目前,已解析的SARS‐Co V‐2RBD与ACE2复合物结构中其结合位点并不完全一致(表1),这可能由于各个实验室的实验策略和方法不尽相同造成的。SARS‐Co V以及其它已发现的与SARS‐Co V‐2同源性最高的动物源冠状病毒(蝙蝠源Co V Ra TG13毒株与SARS‐Co V‐2全基因组同源性为96%[33],穿山甲源Co V Pangolin/GX毒株与SARS‐Co V‐2全基因组同源性为92%[34])在RBD位置主要有6处发生变异。值得注意的是,目前已发现的与SARS‐Co V‐2同源性最高的动物源冠状病毒在这6处与SARS‐Co V‐2非常接近或相同[35]。这些变异在冠状病毒由动物向人实现跨种传播过程中起到什么作用还有待研究。Ou X小组研究显示SARS‐Co V‐2 S蛋白稳定性不如SARS‐Co V[26],这说明SARS‐Co V‐2 S蛋白更易激活,进而容易由融合前结构变为融合后结构。
| 图表编号 | XD00182559800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.11.01 |
| 作者 | 刘晓瑜、魏永伟 |
| 绘制单位 | 绍兴文理学院医学院、绍兴文理学院医学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式