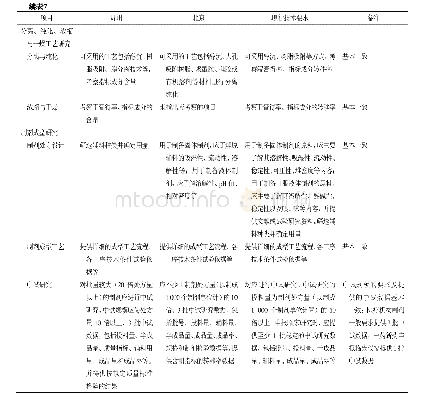
《表1 OMQ和OSI与药品注册申请人合规管理相关的职责》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《美国药品注册申请人合规管理机构设置情况及对我国的启示》
(2)OC。OC的工作目标为尽量避免消费者暴露在不安全、无效和质量不可靠的药品风险中,以促进和保护公众健康。其具体职责包括:计划、制定以患者为中心和以风险为基础的合规和执法政策与措施,以确保药品的安全性、有效性和质量可控性,并负责对标准进行统一解释;领导和监督人用药品执法和合规政策与标准的制定;向中心主任和其他机构官员报告人用药品监管可能存在的风险;执行高层决策,监督绩效,并指导组成部门的战略和运营;设计和制定内部程序和流程以保障工作质量,并监督程序的实施和持续改进情况[4]。该办公室下设机构中与药品注册相关的主要有生产质量办公室(Office of Manufacturing Quality,OMQ)和科学调查办公室(Office of Scientific Investigations,OSI)。OMQ根据ORA现场检查报告和FDA内部研究者收集的信息来评估药品生产企业的合规情况;OSI则负责确保CDER管制的药品、治疗用生物制品和生物类似药具有可靠的安全性和有效性,其具体职责详见表1。
| 图表编号 | XD00179676500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.06.30 |
| 作者 | 姚怡、赵艳蛟、凡馨、陈永法 |
| 绘制单位 | 中国药科大学国际医药商学院、中国药科大学国际医药商学院、中国药科大学国际医药商学院、中国药科大学国际医药商学院 |
| 更多格式 | 高清、无水印(增值服务) |