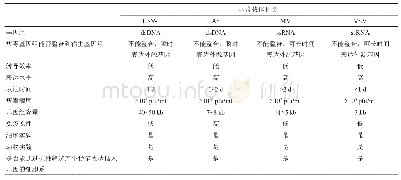
《表1 既往部分腺病毒载体疫苗临床试验开展情况》
目前,腺病毒载体已被广泛应用到疫苗研发领域(表1)。军事医学科学院生物工程研究所和康希诺生物股份公司共同研发的Ad5载体埃博拉疫苗(Ad5-EBOV)目前已经完成I期和II期临床试验,2017年10月获得国家食品药品监督管理总局颁发的新药证书和药品批准文号。针对该疫苗的I期临床试验于2014年在江苏泰州开展(包括4.0×1010vp剂量组、1.6×1011vp剂量组和安慰剂组),6个月后采用同种疫苗开展同源性加强免疫,结果显示,该疫苗在健康中国人群中具有可接受的安全性,抗载体预存免疫会削弱疫苗的免疫应答水平和持久性,这种削弱作用在低剂量组更明显。同源加强免疫后,两个剂量组特异性抗体反应均显著高于初次免疫,这种差异在高剂量组更加明显。加强免疫后抗体反应也更加持久,但加强免疫对T细胞应答水平的增强作用相对较小[16-17]。2015年Ad5-EBOV II期临床试验在塞拉利昂开展(包括1.6×1011vp剂量组、8×1010vp剂量组和安慰剂组)[36],结果同样显示该疫苗具有良好的免疫原性和安全性(表1),并指出8×1010vp可能是最佳剂量,可在III期临床试验进一步研究。
| 图表编号 | XD00159516900 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.08.26 |
| 作者 | 张倩、胡倩倩、王富珍、孙校金、尹遵栋 |
| 绘制单位 | 中国疾病预防控制中心免疫规划中心、中国疾病预防控制中心免疫规划中心、中国疾病预防控制中心免疫规划中心、中国疾病预防控制中心免疫规划中心、中国疾病预防控制中心免疫规划中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式