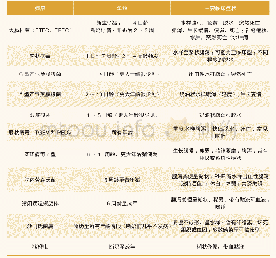
《表3 遗传性疾病模型猪:猪作为人类疾病模型的研究进展》
囊性纤维化(cystic fibrosis,CF)是第7对染色体上CF基因突变引起的常染色体隐性遗传病。CF小鼠模型无法表现与人类相似的肝、肺、呼吸道及肠道病变[27]。2008年,Rogers等[28]采用腺相关病毒(adeno-associated virus,AAV)介导的同源重组技术获得了CFTR双等位基因敲除猪。新生CFTR-/-猪的临床、电生理和病理结果与CF新生儿相似,出现胎粪性肠梗阻、胰腺外分泌功能不全等症状。2013年,Stoltz等[29]建立肠内表达CFTR的CF猪模型。CFTR基因表达可诱导新生仔猪回肠负离子转运,挽救胎粪肠梗阻表型,但无法改善胰腺外分泌功能。血友病A是一种X染色体上的凝血因子Ⅷ异常导致的遗传性疾病。2012年,Kashiwakura等[30]建立了敲除F8基因的血友病A猪模型。模型猪具有与人类血友病A类似的严重出血倾向,且注射人F8凝血因子可起到治疗效果。家族性高胆固醇血症(familial hypercholesterolemia,FH)是一种罕见的常染色体显性遗传病,患者低密度脂蛋白(low density lipoprotein,LDL)水平增高并常伴有早发型冠心病。Carlson等[31]利用TALEN技术构建了LDL受体(LDL receptor,LDLR)基因敲除小型猪,该模型猪是研究FH的理想实验动物模型。家族性腺瘤性息肉病(familial adenomatous polyposis,FAP)是一种常染色体显性遗传性疾病,患者整个结直肠布满大小不一的腺瘤。Flisikowska等[32]通过将突变的腺瘤性息肉病基因(adenomatous polyposis coli,APC)定点插入到猪基因组获得FAP猪,具有与人类相似的发病进程和息肉生长位置。血管性血友病(von Willebrand disease,vWD)是血管性血友病因子(von Willebrand Factor,vWF)基因突变引起的遗传性出血性疾病。利用CRISPR/Cas9技术敲除猪vWF双等位基因,可以获得vWD猪模型[33],该猪出血时间明显延长,表现出严重凝血障碍且血浆中无vWF抗原。酪氨酸血症Ⅰ型(hereditary tyrosinemia type I,HT1)是由于延胡索二酰乙酰乙酸水解酶(fumarylacetoacetate hydrolase,FAH)基因突变而导致FAH缺乏,酪氨酸及其代谢产物蓄积,造成肝损害的伴常染色体隐性遗传病。通过敲除猪FAH基因而建立的人遗传性HT1猪模型,仔猪出现严重肝损伤和与急性肝衰竭等症状。FAH基因敲除猪可用于HT1和自发性急性肝衰竭的研究以及肝细胞治疗效果的临床前测试[34]。酪氨酸酶(tyrosinase,TYR)与人类皮肤白化病的发生相关。TYR双等位基因突变猪的仔猪皮肤、毛发和眼睛中的黑色素完全消失,该模型猪是研究人类白化病发病机制及治疗的重要模型[35](见表3)。
| 图表编号 | XD00159435300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.30 |
| 作者 | 陈雨荣、安星兰、汪正铸、张胜、翟岩辉、代相鹏、李子义 |
| 绘制单位 | 吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学动物医学学院、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式