《表1 糖尿病模型猪:猪作为人类疾病模型的研究进展》
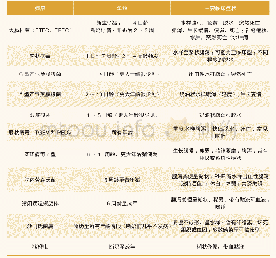
我国成人糖尿病患者数量达1.14亿,高居世界第一[7]。糖尿病会引起心血管和脑血管疾病、视网膜病变、肾病、周围神经病变以及下肢动脉病变等多种并发症[8]。研究表明,猪在进食方式、胰腺形态及发育水平、胃肠道结构、代谢水平以及血糖水平方面与人类非常相似,且糖尿病模型猪在疾病发展方面更接近人[9-10]。Ⅰ型糖尿病(type 1 diabetes mellitus,T1DM)的特征是胰岛素依赖性,主要是由于胰岛β细胞功能遭到破坏引起胰岛素的极度缺乏[11]。通过胰腺切除术获得的Ⅰ型糖尿病猪模型的发病率和死亡率较高且影响了胰腺的外分泌功能,而通过静脉注射链脲佐菌素(streptozocin,STZ,150 mg/kg)诱导的糖尿病动物存活时间长,更适合用于长期的糖尿病研究[12]。Ⅱ型糖尿病(type 2diabetes mellitus,T2DM)占糖尿病总人数的90%以上,其特征是胰岛素抵抗性[13]。1979年,Phillips等[14]人培育成自发性Ⅱ型糖尿病猪“Low K”品系,该品系猪的葡萄糖清除率明显降低,F-5代的葡萄糖耐量降低的遗传率约为0.26,但“Low K”品系葡萄糖耐量降低的特性最终未能维持下来。Xi等[15]利用高脂高糖饲料对中国贵州小型猪进行6个月的诱导饲养后,该猪出现胰岛素抵抗、轻度糖尿病和动脉粥样硬化病变。该模型猪可能是研究糖尿病性血脂异常并发动脉粥样硬化的良好动物模型。吴延军等[16]采用高脂高糖饲料联合低剂量STZ方法成功建立广西巴马小型猪T2DM模型,该模型猪特征明显且更为稳定,均出现胰岛素抵抗和葡萄糖耐量受损等症状。Renner等[17]培育出在胰岛中表达显性抑制肠促胰岛素(glucose-dependent insulinotropic polypeptide receptor,GIP)受体(GIPRdn)的转基因猪,该猪葡萄糖耐量受损,胰岛素分泌减少,β细胞数量减少但凋亡不明显。GIPRdn转基因猪可用于研究GIP在葡萄糖稳态和胰腺发育中的作用。Umeyama等[18]培育出人肝细胞核因子(hepatocyte nuclear factor 1α,HNF1α)突变体猪,22头转基因仔猪中18头在断奶前死亡,其余仔猪胰岛发育不全,非空腹时血糖高于正常水平,该模型可用于研究青少年发病的成人型糖尿病(maturity-onset diabetes of the young,MODY)。胰岛素(insulin,INS)基因的突变会引起永久性新生儿糖尿病(permanent neonatal diabetes mellitus,PNDM)[19]。Renner等[20]培育出在猪胰岛β细胞中特异性表达INSC94Y的突变体猪,该猪的胰岛素蛋白错误折叠,糖尿病表型稳定且其症状可通过胰岛素治疗改善,是胰岛素补充和胰岛移植的良好实验模型(见表1)。
| 图表编号 | XD00159435100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.07.30 |
| 作者 | 陈雨荣、安星兰、汪正铸、张胜、翟岩辉、代相鹏、李子义 |
| 绘制单位 | 吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学动物医学学院、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室、吉林大学第一医院人类疾病动物模型国家地方联合工程实验室 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
![表2 猪主要氨基酸模型和推荐[4]](http://bookimg.mtoou.info/tubiao/gif/TJXM202011015_06800.gif)



