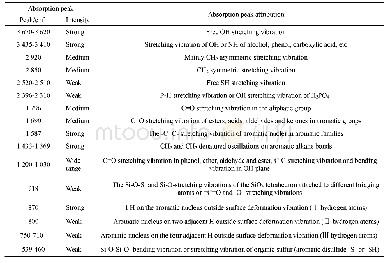
《表1 铝、磷、铬改性皮粉氢键作用关键部位红外光谱谱带归属[4]》
胶原蛋白(皮粉)在红外光谱中各特征吸收谱带归属如表1所示。酰胺A带为N—H伸缩振动,位于3 440 cm-1左右,酰胺B带为N—H伸缩振动或亚甲基氢不对称伸缩振动,位于2 940 cm左右,酰胺I带为酰胺羰基伸缩振动,位于1 660 cm-1左右,酰胺Ⅱ带为三螺旋结构,位于1 560 cm-1左右,酰胺Ⅲ带为N-H弯曲振动或C—N伸缩振动,位于1 240 cm-1左右。从表1可以看出,酰胺A带与酰胺Ⅱ带在铝、磷、铬的鞣制作用下,都向高波数段移动(红移),而酰胺B带与酰胺I带则向低波数段移动(蓝移)。酰胺Ⅰ带的氢键作用对维持胶原蛋白的三股螺旋结构稳定起着关键作用[11];鞣制使得酰胺Ⅰ带蓝移,说明氢键数量有所增加,即鞣制增大了胶原蛋白三螺旋结构的稳定性。
| 图表编号 | XD00142931000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.03 |
| 作者 | 张奇、唐春雪、丁克毅、何达海 |
| 绘制单位 | 西南民族大学化学与环保工程学院、西南民族大学化学与环保工程学院、西南民族大学化学与环保工程学院、西南民族大学药学院 |
| 更多格式 | 高清、无水印(增值服务) |
![《表1 铝、磷、铬改性皮粉氢键作用关键部位红外光谱谱带归属[4]》](http://bookimg.mtoou.info/tubiao/gif/ZGPG202001004_03400.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
2的红外光谱谱图特征峰归属](http://bookimg.mtoou.info/tubiao/gif/GJSZ2020S1023_04900.gif)
2·2H2O的红外光谱谱图特征峰归属](http://bookimg.mtoou.info/tubiao/gif/GJSZ2020S1023_04800.gif)