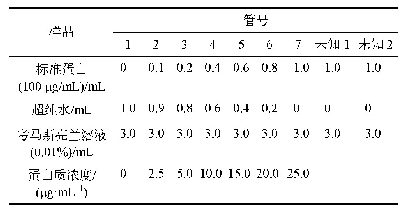
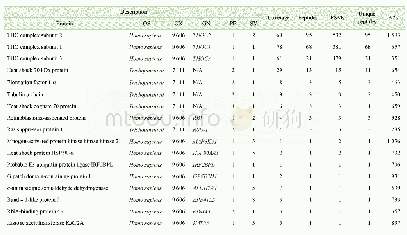
《表1 纯化的THOC1-THOC2-THOC3样品蛋白质组分质谱分析结果》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《人源THOC1-THOC2-THOC3亚复合物的电镜结构研究》
THOC1、THOC2、THOC3亚基在哺乳动物和酵母中均非常保守,但是组分之间的相互作用尚不清楚(图1A);人源THOC2全长为1 593个氨基酸,在进行全长蛋白的外源表达过程中,未能检测到蛋白表达(数据未显示)。通过在线软件FoldIndex[26]对THOC2折叠倾向性进行预测分析发现,在THOC2的C端存在一段很大的无序区域(氨基酸残基:1 191~1 593)(图1B),因此截取THOC2(氨基酸残基:1~1 190)进行外源表达;THOC1和THOC3则选择全长进行表达。THOC2的N端带有10×His标签,THOC1的C端带有Strep标签,用于两步亲和层析。第一步通过Ni-NTA亲和层析获得的目的蛋白质带有少量的杂蛋白质,经过第二步Strep-Tactin亲和层析后得到纯度较高的目的蛋白质样品(图1C)。为了提高样品的均一性,目的蛋白质样品通过Superose 6 Increase10/300 GL进一步分离提纯(图1D),收集所有的流出组分,经SDS-PAGE鉴定(图1E),合并含有目的蛋白质复合物的组分。纯化的样品经过LC-MS/MS鉴定,结果表明纯化所得的样品是THOC1-THOC2-THOC3亚复合物(表1)。经过整个分离纯化步骤,从300 mL的High Five细胞里可纯化出约1 mg的目的蛋白质复合物。
| 图表编号 | XD00137973600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.01.28 |
| 作者 | 刘永湄、谭明、雷鸣 |
| 绘制单位 | 上海交通大学医学院附属第九人民医院上海精准医学研究院、上海交通大学医学院附属第九人民医院上海精准医学研究院、上海交通大学医学院附属第九人民医院上海精准医学研究院 |
| 更多格式 | 高清、无水印(增值服务) |