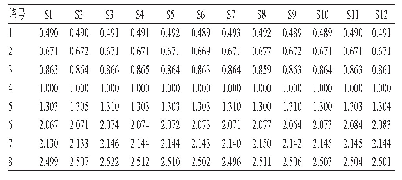
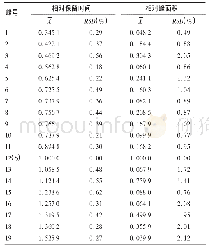
《表1 DSC图谱峰的综合分析》
由表1可以看出,与对照组相比,3组巴氏杀菌处理的热变性温度均升高。其中,72℃15 s处理的酪蛋白变性温度最高,这可能是因为热处理使蛋白质不断解离,转变为更无序的状态,该状态对热较为稳定,当超巴氏杀菌处理时,由于加热温度的升高,酪蛋白胶束与解离的酪蛋白单体之间又凝聚在了一起[31]。热焓(ΔH)表示蛋白质的变性程度,65℃30 min处理的样品吸收峰面积比对照组小,说明热变性程度更高;该组变性温度(90.6℃)高于对照组和超巴氏杀菌组,说明稳定性更高。72℃15 s处理的样品与其他3组相比热焓最低,表明72℃15 s处理的酪蛋白变性程度最大,变性温度(99℃)最高,说明稳定性最高,是因为70℃以上热处理时乳清蛋白会变性,从而与κ-酪蛋白形成复杂的配合物[32]。以上说明,巴氏杀菌(65℃30 min、72℃15 s)处理会提高酪蛋白的稳定性;而121℃5 s处理的酪蛋白变性程度比巴氏杀菌处理的低,可能是因为之前离解的酪蛋白胶束又凝聚交联在一起[33]。
| 图表编号 | XD00123372800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.02.15 |
| 作者 | 张安琪、王玉莹、李瑞、周国卫、王琳、王喜波 |
| 绘制单位 | 东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院、东北农业大学食品学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式