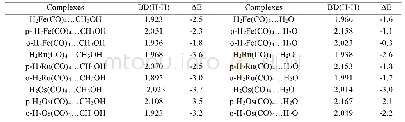
《表3 不同砷化物的键长及相互作用能的优化结果》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《Cu~(2+)对分馏段大庆常顶油不同砷形态的选择性吸附性能研究》
不同砷化物的键长及相互作用能的优化结果如表3所示。由表3可以看出,当不同形式的砷化物与CuO接触形成配合物时,键长均发生了一定程度的变化,9组不同形式的砷化物的C—As键均得到了不同程度的缩短,其中甲基态中的Me2AS的键长变化最为明显,缩短了2.6 pm,键长收缩最小的为Me1AS、Ph3AS,为0.6 pm。表明当砷化物在与吸附剂CuO发生作用时,其本身的结构也得到了加强,AS—Cu键在甲基、乙基、苯基中键长逐渐缩短,成规律性的变化,即(Me1—AS,Me2—AS,Me3—AS)>(Et1—AS,Et2—AS,Et3—AS)>(Ph1—AS,Ph2—AS,Ph3—AS),说明有机砷在与铜物种结合成配合物时,带有苯基态的砷化物则更为稳定,相互作用更强,乙基次之,甲基最弱;同时,当CuO发生配位的同时,Cu—O键随之增长,得到了不同程度的弱化。因此在形成的R—AS—Cu—O键系中,键能方向向着—AS进行偏移,也间接证明了BAR理论[21],当金属离子与砷配位时,C—As键会得到加强,表现为C—As键长缩短。As—H键也同样得到了加强,因为砷的电负性(2.0)小于氢的电负性(2.1),因此,As更容易的给出孤对电子与配位体Cu结合,因此,有机砷中的—As键会推动砷化物与Cu离子的结合,而弱化有机物与Cu粒子表面的竞争。相互作用能显示:在甲基砷的铜配合物中,随着甲基数目的增加,ΔE更小,说明形成的配合物也更加稳定,这种变化规律在乙基砷、苯基砷的铜配物种同样得到了相应的结果。从形成的配合物的总体上分析,这种能量的降低有着Me—AS
| 图表编号 | XD0096198600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.06.20 |
| 作者 | 孟祥祺、赵晓龙、苏国平、赵悦、王晓蔷、黎胜可、施岩 |
| 绘制单位 | 辽宁石油化工大学化学化工与环境学部、辽宁石油化工大学化学化工与环境学部、中石油抚顺石化分公司、中石油抚顺石化分公司、辽宁石油化工大学化学化工与环境学部、辽宁石油化工大学化学化工与环境学部、辽宁石油化工大学化学化工与环境学部 |
| 更多格式 | 高清、无水印(增值服务) |