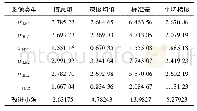
《表1 几种单质和化合物的标准生成焓和标准熵数据比较[9–12]》
化学热力学部分是普通化学这门课程的一个重要组成部分,本部分理论性强,概念繁多,对概念内涵的理解与把握是这一章学习的关键所在。本部分需要学生掌握内容之一如热力学能/焓/熵和吉布斯自由能等状态函数的概念;对热力学能/焓/熵和吉布斯自由能等状态函数的概念理解与掌握对学好本部分内容极其关键。热力学能/焓/熵和吉布斯自由能均为状态函数,并且认为热力学能/焓和吉布斯自由能的绝对值无法求得。规定在热力学标准态下(100 kPa),在某一确定温度下,由指定单质生成1 mol某种物质时的等压热效应用来表示该物质在该温度下的生成焓,用Δf Hm?表示;由指定单质生成1 mol某物质的吉布斯自由能变,称该物质的标准生成吉布斯自由能,用Δf Gm?表示;规定在指定温度(一般298 K)和热力学标准态下指定单质的标准生成焓和标准自由能变为零,才可以求得相应某物质的生成焓和自由能数值。生成焓和自由能数值是一种相对值,有些是实验测定的,有些是间接计算的。在绝对零度时,任何纯净完整晶态物质的熵等于零;热力学第三定律指出在热力学温度0 K时,任何纯物质完整晶体的熵值等于0。某物质从0 K到T K的熵变就是该物质在T K时熵的绝对值,因此在任意温度下,任何物质都有一确定的熵值。教师在讲授这一部分内容时,一般都会给学生查看课本附录中有关物质的生成焓、自由能和熵数据。我们讲授这部分内容时,可以结合当前计算化学的内容,给他们引用有关计算化学获得的焓/自由能和熵数据(见表1)[9–11]。随着计算化学的发展、计算软件的普及和计算机硬件水平的提高,进行较高水平的量化计算成为常态,使得我们能够利用理论计算软件来预测这些数据。引用这些数据时可以适当简单介绍一下有关计算化学的商业软件如基于量子化学的Gaussian计算软件,让他们了解计算化学是如何计算得出这些热力学数据。许多学生对计算化学获得的这些数据产生了兴趣,活跃了课堂气氛,有助于提高他们的听课专注力。
| 图表编号 | XD0086175000 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.09.28 |
| 作者 | 林丽榕、邓顺柳、陈小兰、孔祥建 |
| 绘制单位 | 厦门大学化学化工学院、厦门大学化学化工学院、厦门大学化学化工学院、厦门大学化学化工学院 |
| 更多格式 | 高清、无水印(增值服务) |
![《表1 几种单质和化合物的标准生成焓和标准熵数据比较[9–12]》](http://bookimg.mtoou.info/tubiao/gif/DXHX201909006_00800.gif) 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式