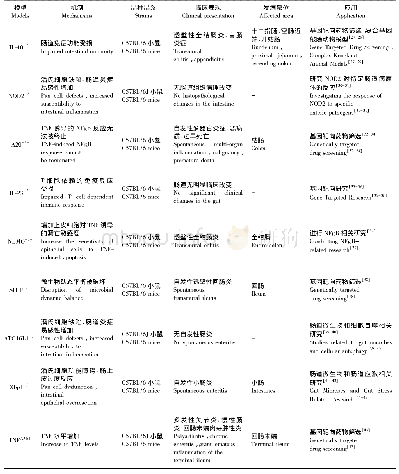
《表1 亨廷顿病模型治疗方案》
不同的HD模型在不同程度上揭示了HD的致病机制、行为表型,提出了很多潜在的治疗靶标。应充分利用不同模型的特色,综合应用于实际HD患者的病情研究中,找寻更好的治疗方案。现已知,HD的病理关键在于具有毒性的HTT蛋白在细胞中的表达与积累,造成特定细胞功能衰竭甚至死亡。因此,目前的治疗策略应着重于该变异蛋白的表达及作用过程,既减少变异蛋白的表达,加速变异蛋白的降解,降低或消除变异蛋白的毒性以及保护受影响的特定细胞免于侵害。最有效的治疗方法应是从根源下手,选择性抑制突变HTT的表达,如反义寡核苷酸抑制和RNA干扰的方法[29]。已知全长HTT蛋白可被相关蛋白酶水解形成N-端HTT蛋白片段,研究表明短的N-端片段更易于在组织中聚集,而一些泛素-蛋白酶体系统(UPS)可干预其降解[30]。突变HTT异常的构象改变了正常HTT与其他蛋白的相互作用方式,例如,Luo等[31]研究发现同型半胱氨酸诱导的内质网蛋白(Herp)能够抑制突变HTT蛋白聚集并且促进其降解。已知突变HTT的积累影响多种正常生命功能,如胞内运输、线粒体功能和突触传递、细胞炎症环境和细胞死亡[32],也可以从中干扰。此外,抗氧化剂可缓解HD病情,而Woodman等[18]研究表明,多不饱和脂肪酸(D-PUFA)可有效降低脂质过氧化(LPO)产物水平,有望改善HD性能。Jin等[33]研究表明PPAR-γ转录因子在N171-82Q模型中调节葡萄糖代谢发挥重要作用。IO-NIS生产的IONIS-HTTRx可针对患者HTT mRNA靶向的反义寡核苷酸ASO可有效降低mHTT和wt HTT的蛋白合成及表达。而治疗HD的另一策略就是从基因水平上降低mHTT蛋白的表达。为了不破坏wt HTT的表达,David-son团队通过对比调控HTT表达的转录起始位点上游2 kb的序列的SNP在人和转基因小鼠中来降低HTT蛋白的表达。然而目前大部分方法在降低mHTT的同时wtHTT也会随之下降,降低WT HTT的安全性就成为值得考虑的问题之一。HTT是胚胎发育的必需基因,在胚胎期敲除可致死[34-37]。然而Wang等[38]证明如果选择性在成年小鼠的脑神经细胞将Htt敲除,揭示出在成年的脑神经细胞中可特异性的完全敲除Htt而不会影响大脑功能。其他研究人员也在成年动物的小鼠、猴模型中降低HTT蛋白并未产生负面作用[39-41]。这些研究均为通过降低Htt的方式来治疗成人HD患者提供了理论依据。基于此原理,Yang等[42]随后利用AAV病毒载体介导CRISPR/Cas9和特异性识别HTT的gRNA特异性的注射到成年HD-KI小鼠大脑的纹状体中,发现可有效清除mHTT所产生的聚集体,并且改善了运动能力。相比siRNA和ASO方法利用cas9介导的基因修复具有永久性抑制内源性mHTT基因表达,只需一次基因操作极具开发潜力。HD大动物模型更能模拟人类HD疾病,因此治疗策略在大动物模型的应用对临床前转化具有重要意义。HD模型治疗方案见表1。
| 图表编号 | XD0048764600 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.04.28 |
| 作者 | 张雪艳、李军、闫森 |
| 绘制单位 | 暨南大学粤港澳中枢神经再生研究院、暨南大学粤港澳中枢神经再生研究院、暨南大学粤港澳中枢神经再生研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式