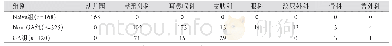
《表1 2014-2017年我国儿童临床用药相关政策Tab 1 The policy of clinical pediatric drug use in China during 2014-2017》
近几年来,国家卫生计生委高度重视儿童临床用药工作,在结合深化医药卫生体制改革、保障民生的基础上,对各个阶段我国儿童药品在临床使用中存在的问题进行梳理,以加快出台一系列的相关政策、法规。在鼓励研发方面,2016-2017年国家卫生计生委先后制定并发布了《首批鼓励研发申报儿童药品清单》(国卫办药政函[2016]573号)[4]、《关于第二批鼓励研发申报儿童药品建议清单的公示》(国卫办药政函[2017]528号)[5],以推动药品生产企业合理调整生产布局,避免盲目研发,以改善临床用药不足的现状。在优先审批方面,2016年国家食品药品监督管理总局发布了《关于解决药品注册申请积压实行优先审评审批的意见》(食药监药化管[2016]19号)[6],该意见加大了临床急需儿童药品的优先审评、审批力度,同时制定并发布了《成人用药数据外推至儿科人群的技术指导原则》(2017年第79号)[7],以减少不必要的儿科用药研究。在临床试验方面,2017年国务院颁布了《关于深化审评审批制度改革鼓励药品医疗器械创新的意见》[8],鼓励开展儿童药品的临床试验,以满足儿童临床用药需求,并对儿童药品给予一定的数据保护期。2014-2017年我国儿童临床用药相关政策见表1。
| 图表编号 | XD0047809200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.01.30 |
| 作者 | 王雪韵、苏巍巍、丁宏、郭文、华雪蔚 |
| 绘制单位 | 安徽医科大学卫生管理学院、国家卫生健康委员会药物政策与基本药物制度司、安徽医科大学卫生管理学院、中国医药工业信息中心、中国医药工业信息中心 |
| 更多格式 | 高清、无水印(增值服务) |
查看“表1 2014-2017年我国儿童临床用药相关政策Tab 1 The policy of clinical pediatric drug use in China during 2014-2017”的人还看了
-

- 表2 社会企业发展的政策变量组合方案Tab.2 Policy variable portfolio alternatives for the development of social enterprises
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式