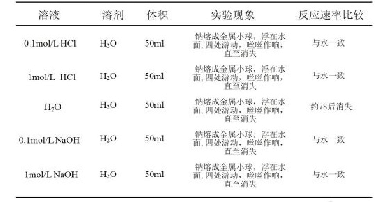
《表3 Cu2+与不同浓度B类盐溶液发生双水解反应的实验现象》
对比表3中组别(1)(2) 的实验现象,向0.1mol/L Na2CO3、NaHCO3溶液中分别滴加相同浓度的CuSO4溶液,2者均立即产生蓝色絮状沉淀,前者为蓝色絮状沉淀,后者为蓝色粉末状沉淀,并均伴随有少量气泡出现,但后者产生气泡的速率明显更快也更多,说明实验(1)(2) 都发生了双水解反应且后者反应速率更快;随后对沉淀进行检验,发现均溶于稀盐酸还伴随着少量气泡的生成,并且能明显观察到实验(2)的反应现象更激烈,说明2者的水解产物都不只生成了Cu(OH)2沉淀,同时还伴随有难溶性的CuCO3生成,即CuSO4溶液与Na2CO3溶液或NaHCO3溶液发生双水解反应的产物均为碱式碳酸铜。并且因为产生的CuCO3含量不同所得到的沉淀的状态也不一样,实验(2)产生的沉淀中CuCO3的含量更高一些;关于实验(2)在双水解反应中产生的气泡明显更多更快的原因,这是因为CuSO4溶液中的Cu2+水解产生H+,当H+与HCO3-结合时,立即产生CO2气体,而只有当H+过量时才会与CO32-结合产生CO2气体。
| 图表编号 | XD0031125800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2019.02.02 |
| 作者 | 郭依玲、丁伟 |
| 绘制单位 | 重庆市育才中学校、华东师范大学教师教育学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式