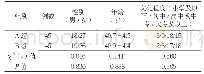
《表1 VGCV组和GCV组患儿一般情况(n=24)》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《缬更昔洛韦治疗新生儿先天性巨细胞病毒感染临床观察》
采用随机数字表法将符合纳入标准的50例先天性CMV感染患儿分为VGCV组和GCV组,在患儿监护人签署知情同意书后进入疗程。VGCV组予以VGCV(上海罗氏制药有限公司,进口药品注册证号:H20100790)口服治疗6周,16 mg/kg,q12h;GCV组予以GCV(江苏涟水制药有限公司,批号:H20041684)治疗6周,静脉滴注,6mg/kg,q12h。治疗过程中每2周复查1次血常规、肝功能和尿CMV-DNA PCR。治疗结束时复查血CMV-DNA PCR、CMV-Ig M、头颅MRI、眼底检查、肝脏B超及脑干听觉诱发电位,并统计经外周静脉穿刺中心静脉置管(PICC)率、住院时间及住院费用。中性粒细胞减少者每周复查1次血常规,如中性粒细胞绝对值<0.5×109/L,暂停治疗,直至复查中性粒细胞绝对值升至0.5×109/L以上再继续疗程。观察治疗期间的不良反应并予以适当的对症治疗。符合本研究纳入标准的患儿50例,GCV组中1例因自动出院未完成治疗,VGCV组1例于治疗中失访,共48例(每组各24例)进入本研究结果分析。2组间一般情况比较差异无统计学意义(P>0.05),见表1。
| 图表编号 | XD00227543700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.25 |
| 作者 | 杨利丽、卢秀丽、王静、王军、潘兆军 |
| 绘制单位 | 徐州医科大学附属医院新生儿科、徐州医科大学淮安临床学院新生儿科、徐州医科大学淮安临床学院新生儿科、徐州医科大学淮安临床学院新生儿科、徐州医科大学附属医院新生儿科、徐州医科大学淮安临床学院新生儿科 |
| 更多格式 | 高清、无水印(增值服务) |



![表1 月龄小于6月组和月龄大于6月组食道狭窄患儿一般情况比较[(±s),n=14]](http://bookimg.mtoou.info/tubiao/gif/KMYX202006025_00500.gif)
