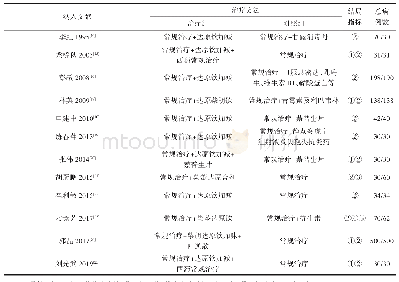
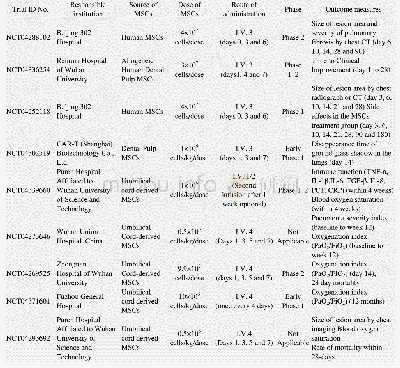
《表1 在Clinicaltrials.gov注册的国内MSCs治疗新冠肺炎的临床试验分析》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《间充质干细胞治疗新型冠状病毒肺炎的研究进展与应用前景》
目前,MSCs及其相关制品已在欧美、日本、澳大利亚等国家和地区进行初步临床应用。但是,现今利用MSCs治疗新冠肺炎的研究成果性文献还报道甚少。目前国内外多家大学、医疗机构、科研单位以及企业启动了数十项MSCs治疗新冠病毒肺炎的相关临床研究[53]。截至2020年7月8日,在国际临床研究注册网站clinicaltrials.gov上的MSCs治疗COVID-19的国内外临床试验备案申请已经多达35项,其中由国内单位组织的9个申请项目的细胞来源、注射剂量和途径等以及试验阶段信息情况如表1所示。国内研究多采用脐带或牙髓组织MSCs的静脉多次(3–4次)注射方式,单次注射剂量在(0.5–10)×106 cells/(kg·dose)之间,受试者在20–100人之间不等,大多数已经开始临床1/2期试验阶段。在国外26项临床试验中,申请机构来自美国、巴西、法国、德国、西班牙以及墨西哥等国的研究单位,采用的MSCs来源包括Nest Cell产品、Wharton’s Jelly-MSCs、脂肪来源MSCs、BMSCs、嗅黏膜MSCs以及MSCs胞外囊泡等,注射方式也为多次(1–5次)静脉注射,剂量范围与国内的范围类似。其中美国南加州大学的一项针对新冠肺炎ARDS症状的临床研究(NCT04371393),利用澳大利亚Mesoblast公司生产的同种异体MSCs制剂(Remestemcel-L),从2020年4月30日开始正在招募300名新冠肺炎受试者,并计划进行维持2年的临床3期试验研究。
| 图表编号 | XD00225187800 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.10.25 |
| 作者 | 师晓栋、于丽佳、丁春光 |
| 绘制单位 | 国家卫生健康委职业安全卫生研究中心、国家卫生健康委职业安全卫生研究中心、国家卫生健康委职业安全卫生研究中心 |
| 更多格式 | 高清、无水印(增值服务) |