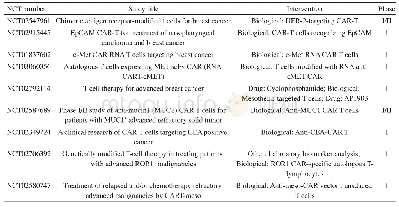
《表1 CAR-T细胞疗法治疗BC的基础研究》
目前在体外实验和动物模型中,针对BC的多种TAA的研究见表1。Wei等[44]发现AXL蛋白在TNBC细胞系MDA-MB-231中高水平表达,且TNBC患者样本中的AXL蛋白水平高于其他BC,AXL-CAR-T细胞在小鼠模型体内对MDA-MB-231肿瘤有显著的生长抑制。Bajgain等[43]通过在针对MUC1的CAR-T细胞上共表达倒置细胞因子受体(inverted cytokine receptor,ICR)来改善BC特异性T细胞的效力,证明了第2代CAR.MUC1和4/7ICR修饰T细胞具有扩增性、持久性、有效的抗肿瘤活性和安全性,支持将这种方法用于BC患者的临床治疗。Zhou等[45]的研究表明:HERV-K env蛋白是一种癌蛋白质,可能在p53和Ras信号通路相关的肿瘤发生中起重要作用,并在体外和体内证实了HERV-K特定CAR(K-CAR)对BC的抗肿瘤作用。Sun等[46]构建了一种新的人源化抗HER2 ch A21sc Fv CAR,证明了基于ch A21sc Fv的HER2特异性CAR-T细胞,不仅在体外识别并杀死HER2(+)BC,而且在体内诱导HER2(+)BC的消退。Rusheni等[47]将CAR基因直接转导到CD3+细胞中,成功地证明了这些基因修饰的CD3+细胞能够特异性地靶向ERBB2过表达BC细胞系SKBR3并诱导细胞凋亡。Yali等[48]研究表明:NKG2D CAR-T细胞可以在体外有效识别和消除表达NKG2DL的TNBC细胞,并且CD27或4-1BB共刺激NKG2D CAR-T细胞,可以显著抑制体内TNBC的生长。Song等[49]研究表明:使用FRαCAR-T细胞对体内及体外的TNBC均具有抗肿瘤活性,且与肿瘤细胞表达的FRα抗原水平呈正相关。Whilding等[50]在BC的小鼠模型中证明了avb6的体内抗肿瘤活性。Klar等[51]证明使用低甲基化剂5-氮杂-2'-脱氧胞苷(hypomethylating agent 5-aza-2'-deoxycytidine,DAC)处理BC细胞,可以以剂量和时间依赖性的方式显著上调BCNY-ESO-1抗原,且通过NY-ESO-1 CAR-T细胞可以有效识别DAC处理的BC细胞并产生细胞毒性作用。Wilkie等[52]证实MUC1和Erb B2“双靶向”的T细胞在体外试验中对Erb B2(+)的BC细胞有显著的抑制效应。Byrd等[53]发现在TNBC干细胞和肿瘤相关脉管中同时存在TEM8。TEM8 CAR-T细胞可以杀死TNBC肿瘤实质细胞、内皮细胞,并抑制BC干细胞样细胞(breast cancer stem-like cells,BCSC)介导的球囊形成,在TNBC的局部和转移性小鼠模型中消除肿瘤新血管系统。对于靶向CAR-T细胞疗法,最关键的是肿瘤特异性抗原的选择。BC瘤内和肿瘤周围的免疫细胞的分布、组成及乳腺肿瘤整体和局部组织免疫环境学均可影响免疫治疗效果。
| 图表编号 | XD00222039700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.09.01 |
| 作者 | 张晴、丁波泥、钱立元、吴唯、文言广 |
| 绘制单位 | 中南大学湘雅三医院乳甲外科、中南大学湘雅三医院乳甲外科、中南大学湘雅三医院乳甲外科、中南大学湘雅三医院乳甲外科、中南大学湘雅三医院乳甲外科 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式