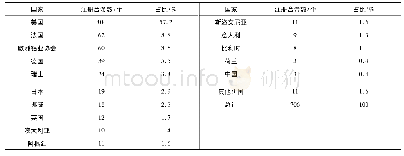
《表2 不同国家的注册人在我国取得医疗器械注册证的数量统计(个)》
在注册技术审查规范方面,验光仪已有发布实施的注册审查指导原则,视力筛查仪尚无指导原则。梳理国家药品监督管理局申报产品的情况,对于验光仪,注册申报中的常见问题如下。(1)对产品所具有的各项软件功能的说明不够明确,且相应的验证不够充分:验光仪具有的主要软件功能,特别是涉及用户操作或主要性能指标的软件功能应进行充分的说明和验证。(2)未提交光辐射安全性研究资料:验光仪通常具有光源,且无论是测试光还是固视光均会入射人眼,因此,对于眼科仪器,除性能参数外,光辐射安全性评价亦是具有普遍适用性的要求,目的是评价光辐射对人眼的安全性。(3)性能参数验证与说明书记载不一致:说明书是提供给用户的重要随附文件,其中的性能参数部分属比较核心的内容,所有涉及产品性能的验证应围绕产品实际情况展开,并与说明书保持一致。(4)产品性能参数不完全符合强制性标准YY 0673-2008《眼科仪器验光仪》[8]的要求:产品应符合所适用的强制性标准的要求是医疗器械注册包括产品质量体系中的一项基本要求。(5)产品的光源信息不明确:眼科器械所具备的光源性质,特别是光输出特性,与产品性能及安全密切相关,是需要明确的信息。对于视力筛查仪的注册审报需关注以下几点:(1)市场上的同类设备若原理不同,则应区分并说明申报产品的原理;(2)应特别关注产品的性能指标制定的科学合理性,尤其需考量是否能够充分满足实际筛查工作的需要,应有充分的产品性能及应用的研究及验证;(3)应关注视力筛查仪测试的稳定性设计,特别是测试距离及测试环境如何保证的问题,这两方面直接关系测试结果的准确性,应关注产品在此方面的设计及验证;(4)与验光仪相同,视力筛查仪作为眼科器械,同样需考量预期射入人眼的光辐射的安全性问题,并应有相关评价及验证。
| 图表编号 | XD00213156300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.01.15 |
| 作者 | 金若男、孙克英 |
| 绘制单位 | 国家药品监督管理局医疗器械技术审评中心、国家药品监督管理局医疗器械技术审评中心 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式