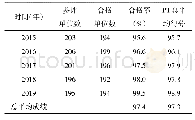
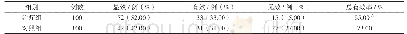《表2 临床免疫安全性评价》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《基于重组技术的低毒力高效大肠杆菌原核表达系统的改造与应用》
注:-:无该项数据
不同宿主来源的VP2蛋白纯化后制备疫苗,其中E.coli BL21(DE3)和E.coli BL21(DE3)?lpx M宿主对应免疫组(组1和组2)的内毒素配苗含量分别为35 000 EU/m L和40 000 EU/m L,前者疫苗注射后免疫组个体的免疫部位出现较轻微的肌肉充血、水肿和硬结,并有轻度的腹泻、精神萎靡和食欲减退等副反应症状,后者免疫组个体与阴性对照组均无明显临床症状出现(表2)。此外,E.coli BL21(DE3)和E.coli BL21(DE3)?lpx M::tig宿主通过不同表达载体表达的抗原蛋白,纯化后按照相同抗原含量进行疫苗制备(组3和组4),其内毒素含量检测结果分别为5 000 EU/m L (组3)和1 000 EU/m L (组4),免疫动物后均无明显临床症状出现(表2)。该试验结果指示,lpx M缺失后宿主菌株合成内毒素的毒力水平显著下降,利用所构建突变株表达的抗原蛋白进行纯化更有利于内毒素的去除。
| 图表编号 | XD00212132100 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.20 |
| 作者 | 黄玉欣、李鹏昊、王孟月、吴芃、刘鹏、逄文强、田克恭 |
| 绘制单位 | 国家兽用药品工程技术研究中心、国家兽用药品工程技术研究中心、国家兽用药品工程技术研究中心、国家兽用药品工程技术研究中心、国家兽用药品工程技术研究中心、国家兽用药品工程技术研究中心、国家兽用药品工程技术研究中心 |
| 更多格式 | 高清、无水印(增值服务) |