《表1 针对工业异构酶的部分改造研究》
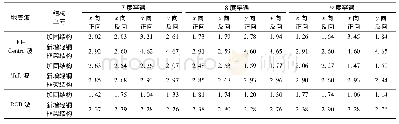
学者们针对前述各类异构酶展开了大量研究,主要目的在于改造它们从而获得更好的催化性能和热稳定性(如表1总结),下面列举有代表性的案例。对CE酶的改造包括酶活力的提升、热稳定性增强、副产物降低等几个方面。对Ruminococcus albus CE的研究表明保守残基R52、H243、E246、W249、W304、E308和H374影响酶活力,其丙氨酸突变体均完全失活,F114和W303也对活性有很大影响。晶体结构研究表明,H243、W249、H374、H377和M378位于活性中心入口处,R52和F114在活性中心的底部,2个组氨酸H374和H243作为广义酸碱执行催化反应;活性口袋的整体疏水性较强,确保底物不被水解[46]。对CSCE的研究表明,双点突变E161D/N365P酶活性半衰期延长了4倍,最适反应温度由80℃上升到87.5℃,对乳糖的催化效率kcat/Km上升了29%[47]。通过4轮基于随机突变的定向进化筛选,SHEN等[48]又将CSCE的酶活性和催化效率分别提升了2.8和3倍,突变体酶有5个位点改变(R5M/I52V/A12S/K328I/F231L)。令人意外的是突变体酶不产依匹乳糖,使得乳果糖产率上升到76%。由于R5、A12、K328和F231都是位于CSCE酶表面的残基,因此它们对产物选择性的影响尚无法阐述。而I52距离活性中心仍然较远,因而需要晶体结构研究进一步揭示这些残基对催化产生的影响。对L-AI酶的改造包括酶活力提升、最适温度和p H改造等,G.thermonitrificans L-AI的突变体F280 N/C450S/N475K具有更高的转换数kcat值,达到6 245 min-1,催化效率kcat/Km达到4.7 L/(mmol·min)[49]。对MPI酶的改造包括定点突变获得R142 N突变体,其kcat值达到81 063s-1,是野生型的1.6倍[50]。总结以上研究可得出结论,异构酶普遍缺乏高通量的突变体筛选方法,产物检测依赖高效液相色谱,因此常使用基于理性设计的定点突变方法以减少样品数量。
| 图表编号 | XD00209291500 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.03.15 |
| 作者 | 徐铮、徐恺、陈昱金、李丽、付铭洋 |
| 绘制单位 | 南京工业大学食品与轻工学院、南京工业大学食品与轻工学院、南京工业大学食品与轻工学院、南京工业大学食品与轻工学院、南京工业大学食品与轻工学院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式