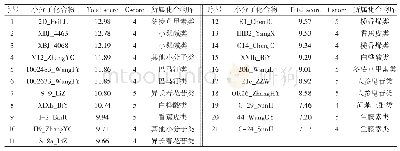
《表2 HDAC6与HSP90抑制剂联用治疗肿瘤》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《HDAC6-HSP90途径介导蛋白折叠和降解调控肿瘤细胞增殖与转移》
随着HDAC6与HSP90之间相互作用的深入研究,HDAC6抑制剂与HSP90抑制剂的联合应用成为了癌症治疗中更为有效的新突破点.GA及其衍生物(如17-AAG、Alvespimycin)相比于核苷酸以更高的亲和力与ATP/ADP结合口袋相结合,从而抑制了HSP90与客户蛋白的结合能力.同时有研究表明,抑制HDAC6可增强HSP90与17-AAG的结合,HSP90高度乙酰化使ATP与HSP90的结合减弱,导致HSP90与AR(androgen receptor)、GR(glucocorticoid receptor)和ERα(estrogen receptor)及其他相关癌蛋白激酶,如Bar-Abl、FLT-3(FMS-like tyrosine kinase-3)、AKT和HER-2(表皮生长因子受体)等客户蛋白的结合被破坏[86~89].在白血病细胞中,HSP90抑制剂17-AAG联合HDAC6抑制剂,通过促进HSP90高度乙酰化,更有效地抑制HSP90与客户蛋白的结合,从而达到抑制肿瘤细胞增殖转移的目的(表2).抑制HDAC6可以破坏HSP90与客户蛋白的结合能力,抑制食管鳞状细胞癌(esophageal squamous carcinoma,ESCC)的增殖和转移.在ERα高表达的乳腺癌细胞系T47D中,HDAC6与HSP90抑制剂的联用导致ERα的表达显著降低(表2).尽管人们对HDAC6与HSP90抑制剂联合应用治疗肿瘤有了一定认识(表2),但还存在许多问题.目前已经发现了许多癌症相关蛋白受到HSP90的调控,例如AKT、c-Raf(Ras-associated factor-1)、HER-2等,这为HSP90抑制剂在肿瘤中的应用提供了理论依据.但HSP90作用范围的广泛性导致其在癌细胞中发挥的作用远比预期的更为复杂,可能引起“脱靶效应”(off target)[90].同时,还应考虑到不同类型的肿瘤对于HSP90抑制剂的敏感性是否存在差异?如何降低抑制剂对于正常细胞的毒性作用?解决以上问题为HDAC6-HSP90抑制剂的临床应用以及肿瘤的精准治疗提供理论依据.
| 图表编号 | XD00200888700 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.30 |
| 作者 | 田睿、颜晓羽、于司杭、许龙、赵元馨、孙连坤、苏静 |
| 绘制单位 | 吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |