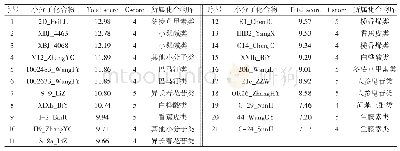
《表1 肿瘤相关的HSP90客户蛋白》
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式
本系列图表出处文件名:随高清版一同展现
《HDAC6-HSP90途径介导蛋白折叠和降解调控肿瘤细胞增殖与转移》
研究发现,HSP90通过调控客户蛋白折叠参与肿瘤细胞增殖、凋亡以及血管生成等多条信号[2 5].HSP90维持生长因子受体生存信号激酶,如AKT、磷脂肽肌醇-3-激酶(lecithin exception inositol-3-kinase,PI3K),以及癌基因的稳定[26,27].在伯基特(Burkitt)淋巴瘤中,HSP90抑制剂PU-H71处理24 h后,PI3K下游的4E结合蛋白1(4E-binding protein 1,4EBP1)蛋白表达显著降低,表明HSP90参与了PI3K途径关键蛋白的调控[28].应激状态下HSP90-AKT与促凋亡激酶ASK1(apoptpsissignal regulating kinase 1)形成的复合物抑制了ASK1的促凋亡活性;而当抑制HSP90时,该复合物(HSP90-AKT-ASK1)的构象则会发生变化,ASK1的促凋亡活性被重新激活,由此增强了应激物(如H2O2)诱导的细胞凋亡.HSP90还可以通过结合血管内皮生长因子(vascular endothelial growth factor,VEGF),激活一氧化氮合酶(nitric oxide synthase,NOS)和基质金属蛋白酶2(matrix metalloproteinase 2,MMP2)促进血管的生成和转移[11].VEGF刺激内皮细胞将e NOS和AKT募集到HSP90结构上,促进e NOS磷酸化、酶的激活以及NO的释放[29].线粒体中,HSP90与TRAP1(TNF receptor associated protein 1)、CYLD(cyclophilin D)和survivin相互作用,发挥抗凋亡功能.研究表明,用HSP90抑制剂GA(geldanamycin)处理He La细胞后,HSP90伴侣功能受到抑制,客户蛋白被蛋白酶体降解,survivin的表达随GA浓度的变化呈现依赖性损失,并因此诱导了线粒体凋亡的激活[30].据报道,在氧化过程中由亚基环组成的20S蛋白酶体蛋白复合物通过结合HSP90,选择性识别和降解客户蛋白.氧化的钙调蛋白(calmodulin,Ca M)仅在HSP90存在的情况下才会被20S蛋白酶体显著降解(表1).以上研究提示,HSP90可能为肿瘤治疗的潜在靶点.
| 图表编号 | XD00200888200 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2020.12.30 |
| 作者 | 田睿、颜晓羽、于司杭、许龙、赵元馨、孙连坤、苏静 |
| 绘制单位 | 吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室、吉林大学基础医学院病理生理学教研室病理生理学教育部重点实验室 |
| 更多格式 | 高清、无水印(增值服务) |