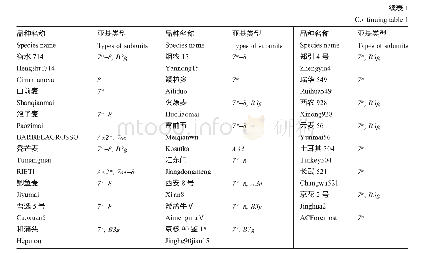
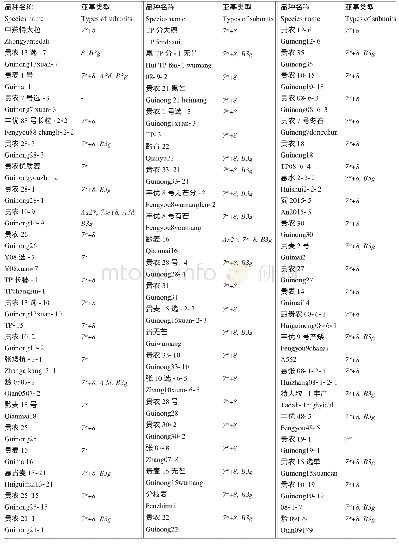
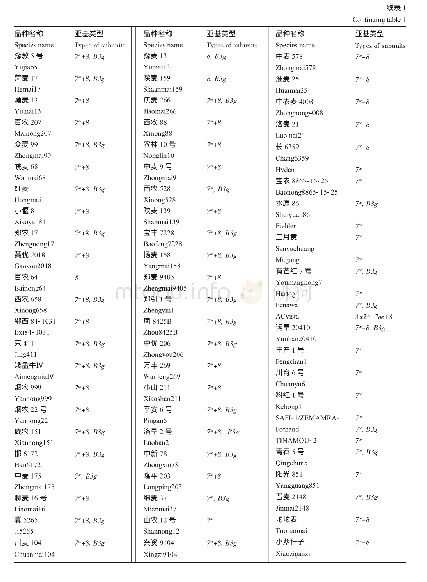
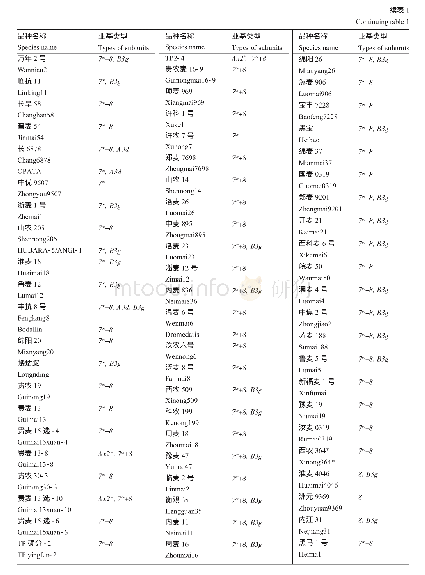
《表7 六聚体内相邻蛋白亚基的结合能》
六聚体内相邻蛋白亚基间的结合自由能见表7。六聚体内相邻亚基间的平均结合自由能为-221.2 k J/mol,比五聚体更稳定。结合能分量(35)Gvdw=-577.3 k J/mol,表明(35)Gvdw是维持六聚体稳定的关键因素,(35)Gelec和(35)GPB分别为103.4和306.8 k J/mol,且从绝对值看,二者之和占(35)Gvdw和(35)Gnp之和的65.0%,对亚基间的亲和作用不利。为验证复合物中形态一致的两个六聚体的自由能是否一致,计算了复合物中的另外一个六聚体结构,其亚基间的平均结合自由能为-213.6 k J/mol,六聚体总结合自由能为-1281.8 k J/mol,两个六聚体间的总自由能差异仅为3.4%。该数据表明,HBc-VLPs中处于不同位置处的五聚体或六聚体,其结合自由能基本相同。当蛋白介电常数取经验值6.0(表4),则(35)Gelec和(35)GPB分别提高了93.0和77.2 k J/mol,蛋白亚基间的平均结合自由能仅占表7中计算结果的23.1%,该结果比HBc-VLP中的二聚体和五聚体相应差异更显著。由此可知,忽略不同亚基复合物中蛋白分子所处的局部环境,即忽略蛋白分子上静电分布及其动态结构对介电常数的影响,采用经验介电常数计算亚基间的结合能不准确。
| 图表编号 | XD00198062300 严禁用于非法目的 |
|---|---|
| 绘制时间 | 2021.02.01 |
| 作者 | 马艳艳、李正军、张松平、陈卫、任瑛 |
| 绘制单位 | 中国科学院过程工程研究所多相复杂系统国家重点实验室、中国科学院大学化学工程学院、中国科学院过程工程研究所生化工程国家重点实验室、中国科学院过程工程研究所生化工程国家重点实验室、中国科学院过程工程研究所多相复杂系统国家重点实验室、中国科学院洁净能源创新研究院、中国科学院过程工程研究所多相复杂系统国家重点实验室、中国科学院绿色过程制造创新研究院 |
| 更多格式 | 高清、无水印(增值服务) |
 提示:宽带有限、当前游客访问压缩模式
提示:宽带有限、当前游客访问压缩模式